
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将Na块投入水中,产生气体:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 0.1 mol•L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O═SO32-+H3O+ | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.离子个数配比不符合物质结构;
B.电荷不守恒;
C.亚硫酸氢根离子为弱酸的酸式根离子,部分电离,用可逆号;
D.二者反应生成硫酸铵和氢氧化铝沉淀.
解答 解:A.向Ba(OH)2溶液中滴加稀硫酸,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.将Na块投入水中,产生气体,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.0.1 mol•L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O?SO32-+H3O+,故C错误;
D.向Al2(SO4)3溶液中加入过量的NH3•H2O,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确离子反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
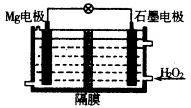 钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用.
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Br-、Al3+、H+、CO32-、H2PO4-这些离子都能破坏水的电离平衡 | |
| B. | 常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,溶液的pH变小 | |
| C. | CuSO4、K2CO3、KMnO4的水溶液分别在空气中小心加热蒸干至质量不再减少为止,都能得到较纯净的原溶质 | |
| D. | Na2C2O4溶液中存在:c(OH-)=c(H+)+c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、CO2 都是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物相同 | |
| C. | SO2、NO、CO2都是大气污染物,在空气中都能稳定存在 | |
| D. | HCl、HNO3都是强酸,和FeO的反应都属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
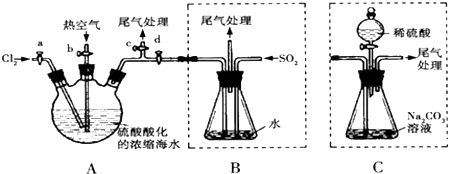
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度实验次数 | 起始温度t2 /℃ | 终止温度 t2 /℃ | 温度差平均值 (t2- t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
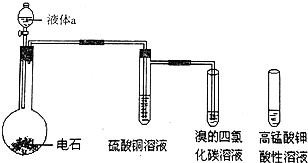 如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略.
如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 实验目的 |
| A | 将一定质量的FeCl3固体加入沸水中 | 配制FeCl3溶液 |
| B | 将一定质量的TiCl4加入大量热水中,充分反应后,过滤,洗涤 | 制取TiO2•xH2O |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 将适量溴水加入KI溶液中,振荡,再加入CCl4,振荡,静置 | 验证Br2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com