
| A. | 向NaClO溶液中通入少量SO2 2ClO-+SO2+H2O=2HClO+SO${\;}_{3}^{2-}$ | |
| B. | 向Fe2(SO4)3溶液中通入足量的H2S Fe3++H2S=Fe2++S↓+2H+ | |
| C. | 向FeBr2中通入等量Cl2 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | Fe(OH)3和HI的反应 Fe(OH)3+3H+=Fe3++3H2O |
分析 A.次氯酸根离子能够氧化二氧化硫生成硫酸根离子;
B.电荷不守恒;
C.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,剩余氯气再氧化溴离子;
D.三价铁离子能够氧化碘离子.
解答 解:A.向NaClO溶液中通入少量SO2,离子方程式:ClO-+H2O+SO2═SO42-+2H++Cl-,故A错误;
B.Fe2(SO4)3的酸性溶液中通入足量硫化氢,硫化氢被铁离子氧化成硫单质,离子方程式必须满足电荷守恒,正确的离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+,故B错误;
C.向FeBr2中通入等量Cl2,离子方程式:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故C正确;
D.Fe(OH)3和HI的反应,离子方程式:2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应必须遵循客观事实,注意反应物对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:解答题

 ),M的一种合成路线如图(部分反应试剂和条件省略).
),M的一种合成路线如图(部分反应试剂和条件省略).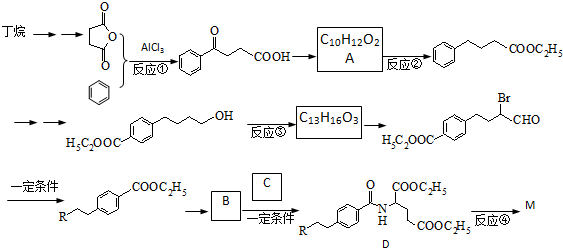
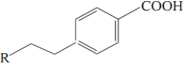 ,C
,C ;
;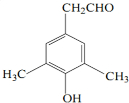 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1 CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应①的产物比反应②的产物稳定 | |
| D. | 物质的量相同时,反应②的反应物总能量比反应①的反应物总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A2):c(B2):c(AB)=1:1:2 | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | 单位时间内生成n molA2的同时生成n mol B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
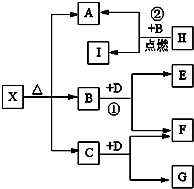 Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题: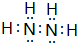 .将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
.将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.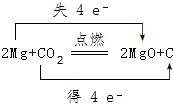 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{1000ρw}{M}$ | B. | m=V•ρ•$\frac{w}{100}$ | C. | w=$\frac{cM}{1000ρ}$ | D. | c=$\frac{1000m}{MV}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br-<Fe2+<I- | B. | I-<Fe2+<Br- | C. | Br-<I-<Fe2+ | D. | Fe2+<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com