
 (标出配位键).
(标出配位键).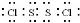 ,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.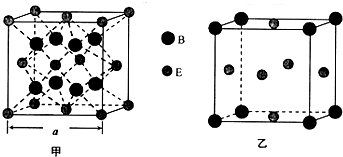
分析 周期表前四周期元素A、B、C、D、E、F原子序数依次增大,A、B、C、D是不同主族短周期元素,其中两种为金属元素,A基态原子有四种不同运动状态的电子,A为C,A与D、B与C这两对原子的最外层电子数之和均为9,B为Al,C为S,D为Cl;E在ds区,基态原子有未成对的电子,E为Cu,F基态原子的P轨道为半充满状态,F为As,
(1)C为S元素,原子核外电子数为16,根据能量最低原理书写核外电子排布为1s22s22p63s23p4;D为Cl,同元素的含氧酸,非羟基氧数目越多,酸性越强;
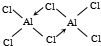
(2)A、B都能与D形成中心原子杂化的简单的两元共价化合物为BeCl2和AlCl3,BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取
sp杂化方式,AlCl3中Al原子成3个Al-Cl,Al原子的杂化轨道数为3,故Al原子采取sp2杂化方式;B与D还可以形成二聚体分子Al2Cl6,其二聚体分子的结构式为 ,根据结构式知道其中心原子的杂化方式为sp3;
,根据结构式知道其中心原子的杂化方式为sp3;
(3)F与D能形成FDx化合物,当x=5时,该分子为PCl5,中心原子P原子成5个σ键,P原子价层电子对是为5+$\frac{1}{2}$(5-5×1)=5,含有0对孤对电子对,空间构型为三角双锥,正负电荷中心重合,故为非极性分析;PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,空间构型为三角锥形;
(4)S2Cl2电子式为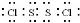 ,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl;
,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl;
(5)根据均摊法计算分子式,根据m=ρ×v计算阿伏伽德罗常数.
解答 解:周期表前四周期元素A、B、C、D、E、F原子序数依次增大,A、B、C、D是不同主族短周期元素,其中两种为金属元素,A基态原子有四种不同运动状态的电子,A为C,A与D、B与C这两对原子的最外层电子数之和均为9,B为Al,C为S,D为Cl;E在ds区,基态原子有未成对的电子,E为Cu,F基态原子的P轨道为半充满状态,F为As,
(1)C为S元素,原子核外电子数为16,根据能量最低原理书写核外电子排布为1s22s22p63s23p4;D为Cl,高氯酸中非羟基氧原子为3个,而氯酸中为2个(或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价对羟基氧原子吸引能力较弱),故高氯酸的酸性更强,
故答案为:1s22s22p63s23p4;高氯酸中非羟基氧原子为3个,而氯酸中为2个(或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价对羟基氧原子吸引能力较弱);
(2)A、B都能与D形成中心原子杂化的简单的两元共价化合物为BeCl2和AlCl3,BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取
sp杂化方式,AlCl3中Al原子成3个Al-Cl,Al原子的杂化轨道数为3,故Al原子采取sp2杂化方式;B与D还可以形成二聚体分子Al2Cl6,其二聚体分子的结构式为 ,根据结构式知道其中心原子的杂化方式为sp3,故答案为:sp;sp2;sp3
,根据结构式知道其中心原子的杂化方式为sp3,故答案为:sp;sp2;sp3 ;
;
(3)F与D能形成FDx化合物,当x=5时,该分子为PCl5,中心原子P原子成5个σ键,P原子价层电子对是为5+$\frac{1}{2}$(5-5×1)=5,含有0对孤对电子对,空间构型为三角双锥,正负电荷中心重合,故为非极性分析;PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,空间构型为三角锥形,故答案为:非极性;三角锥形;
(4)S2Cl2是一种琥珀色液体,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊,S2Cl2电子式为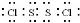 ,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,故答案为:
,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,故答案为: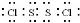 ;2S2Cl2+2H2O═SO2↑+3S↓+4HCl;
;2S2Cl2+2H2O═SO2↑+3S↓+4HCl;
(5)根据均摊法计算,甲中,Al:8×1=8,Cu:8×$\frac{1}{8}$+6×$\frac{1}{2}$=1+3=4,故分子式为CuAl2,;乙中:Al:8×$\frac{1}{8}$=1,Cu:6×$\frac{1}{2}$=3,故分子式为Cu3Al;甲晶胞中含有Cu数目4,Al为8,晶胞质量为4×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$,该晶胞的边长为acm,则晶胞体积为(acm)3,晶胞密度为ρg/cm3,故4×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$=(acm)3ρg/cm3,M=(64+27×2)g/mol,故NA=$\frac{4×(64+54)}{{a}^{3}ρ}$,故答案为:CuAl2;Cu3Al;$\frac{4×(64+54)}{{a}^{3}ρ}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、价层电子对互斥理论、杂化方式、分子结构与性质、晶胞计算等,需要学生具备一个的空间想象与数学计算能力,题目难度较大.


科目:高中化学 来源: 题型:选择题
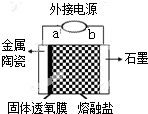 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,Ti4+在熔融盐中从左往右迁移 | |
| B. | 阳极电极反应式为2Cl--2e-=Cl2↑ | |
| C. | 已知每摩尔电子的电量为965 00 C,理论上生成48mg钛,则电解过程中通过电解池的电量为386 C | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
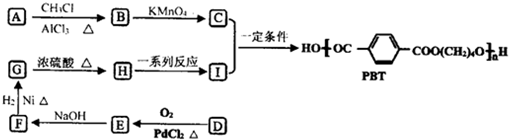

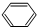 ,B的核磁共振氢谱有2个峰.
,B的核磁共振氢谱有2个峰.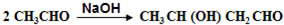 .
.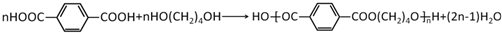 ,该反应类型为缩聚反应.
,该反应类型为缩聚反应.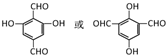 或
或 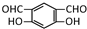 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
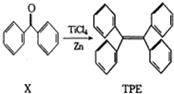
| A. | X的一氯代物有5种 | |
| B. | 1个TPE分子中最多有26个碳原子共面 | |
| C. | TPE不能发生取代反应,但能发生加成反应 | |
| D. | TPE不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
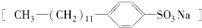 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
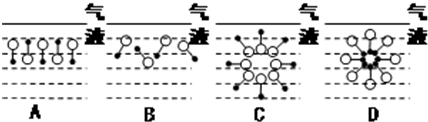
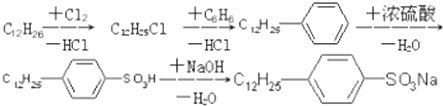
 .
. ,反应类型为取代反应.
,反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变 | |
| B. | 将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3 | |
| C. | 25℃时,用pH相同的稀醋酸和盐酸分别中和同浓度、同体积的NaOH溶液至混合溶液呈中性时,消耗稀醋酸和盐酸的体积相同 | |
| D. | 25℃时,pH=9的NH4Cl与NH3•H2O混合溶液中c(Cl-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温常压下,2.0g重水(D2O)中含NA个电子 | |
| C. | 1.0L0.1mo1•L-1的NaHCO3溶液中含HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1mol N2与4mol H2反应生成的NH3分子数为2NA | |
| C. | 1mol Fe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移除导管 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com