
已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
科目:高中化学 来源: 题型:
将N2、H2的混合气体分别充入甲、乙、丙三个容器后,测得反应速率分别为甲:v(H2)=3 mol/(L·min);乙:v(N2)=2 mol/(L·min);丙:v(NH3)=1 mol/(L·min)。则三个容器中合成氨的速率( )
A.v(甲)>v(乙)>v(丙) B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙) D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________________________________________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
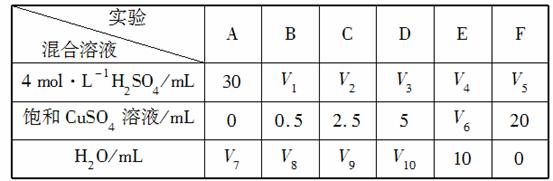
①请完成此实验设计,其中:V1=________,V6=________,V9=________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
写出具有下列分子式但仅有一个核磁共振信号的化合物的结构简式:
(1)C5H12:____________________________________________;
(2)C2H6O:___________________________________________;
(3)C2H4Br2:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1) COCl2的空间构型为 ;溴的价电子排布式为 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。

(4)下列分子既不存在s-p 键,也不存在p-p
键,也不存在p-p 键的是 。
键的是 。
A. HCl B.HF C. SO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为 ,写出CN-的等电子体的分子式 (写出1个)。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 。已知该氧化物的密度是 g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3g)+Cl2(g)  PCl5(g) 达到平衡时,PCl5为0.4mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g) 达到平衡时,PCl5为0.4mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40mol B.0.20mol C. 大于0.20mol,小于0.40mol D. 小于0.20mol
查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是________________________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”) (3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热的数值________(填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将溴水分别与酒精、己烯、己烷和四氯化碳四种试剂混合,充分振荡后静置,下列现象与所加试剂不相吻合的是( )
| A | B | C | D | |
| 与溴水混合的试剂 | 酒精 | 己烯 | 己烷 | 四氯化碳 |
| 现象 |
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com