
【题目】将0.0100mol·L-1的NaOH溶液滴入浓度为0.0100mol·L-1,体积为20.00mL的CH3COOH溶液.在滴加过程中n(CH3COOH)和n(CH3COO-)随溶液pH的分布关系如图。下列说法不正确的是( )
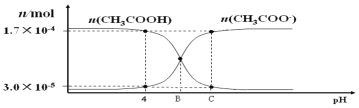
A.pH=4时,醋酸的电离常数Ka≈1.8×10-5
B.B点时,c(CH3COOˉ)=c(CH3COOH)
C.B点时,在溶液中滴入酚酞试剂,溶液显红色
D.C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ)
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 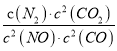 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
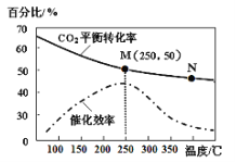
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
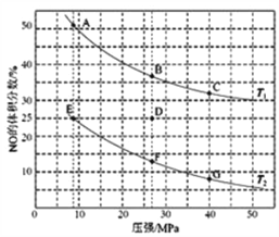
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中
是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中![]() 、
、![]() 、
、![]() 的组成百分率与pH的关系如图所示,下列说法正确的是( )
的组成百分率与pH的关系如图所示,下列说法正确的是( )
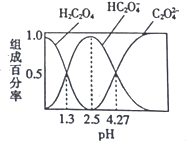
A.![]() 的溶液中:
的溶液中:![]()
B.反应![]() 的平衡常数为
的平衡常数为![]()
C.向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D.![]() 的溶液中:
的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
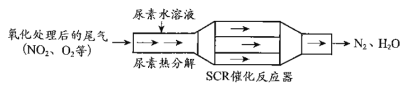
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:__________________
②反应器中NH3还原NO2的化学方程式:________________________;
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________________________;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________;
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
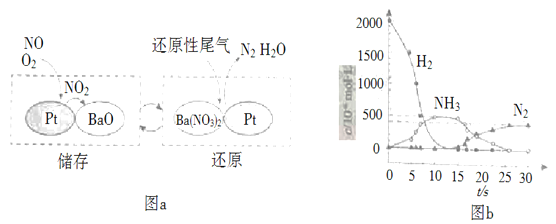
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。还原NOx的物质是_________________;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与Ba(NO3)2的物质的量之比是__________________;
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:__________________![]() ____15NNO+___H2O
____15NNO+___H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
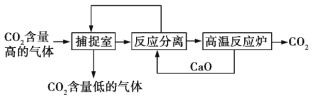
下列有关该方法的叙述中正确的是
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国计划2020年再次登陆月球,并在月球上建立永久性基地,为人类登陆新的行星做好前期准备。为了解决基地人员的供氧问题,科学家设想利用月球富氧岩石制取氧气。其提氧原理是用氢气还原富氧岩石获取水,再利用太阳能电池电解水得到氢气和氧气。
玄武岩(含钛铁矿)是月球的主要岩石之一,其质地坚硬,钛铁矿的主要成分为钛酸亚铁(![]() )。用上述提氧原理,理论上,从1 kg
)。用上述提氧原理,理论上,从1 kg ![]() 中可获取105.3g
中可获取105.3g ![]() 。
。
(1)写出![]() 与
与![]() 反应的化学方程式:______________________________________________。
反应的化学方程式:______________________________________________。
(2)研究表明,月球上平均直径为40微米的小圆珠形成的堆积物(富含![]() )是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
)是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
(3)研究人员查阅文献后,得知钛铁矿在高温下还能被炭粉还原: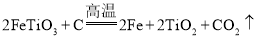 ,
,![]() 通过植物的光合作用可获得
通过植物的光合作用可获得![]() ,化光学方程式为
,化光学方程式为![]() (葡萄糖)
(葡萄糖)![]() 。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
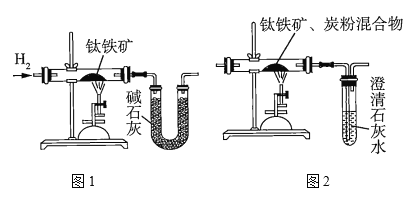
研究人员用图1装置从钛铁矿中提取氧,实验中得出的可提取氧的质量分数大于理论值,产生这种情况的原因可能是______________________;用图2装置进行实验的过程中,称得反应前钛铁矿的质量为![]() ,炭粉的质量为
,炭粉的质量为![]() ,钛铁矿完全反应后,测得生成
,钛铁矿完全反应后,测得生成![]() 的质量为
的质量为![]() ,则钛铁矿中可提取氧的质量分数为________________。
,则钛铁矿中可提取氧的质量分数为________________。
(4)在钛铁矿提氧过程中科学家们常选用![]() 而不用其他还原剂,其主要原因是______________________。
而不用其他还原剂,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值、单位,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g)![]() 2HI(g)ΔH=-9.48kJ·mol-1
2HI(g)ΔH=-9.48kJ·mol-1
(ii)I2(s)+H2(g)![]() 2HI(g)ΔH=+26.48kJ·mol-1
2HI(g)ΔH=+26.48kJ·mol-1
下列判断正确的是( )
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。
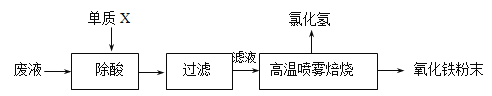
(1)单质X的化学式是___________。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为:_____________________________________________________________________。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3molL-1H2SO4、0.1 molL-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
操作步骤 | 预期现象和结论 |
步骤1.取少量样品于试管中,_______________ | 样品全部溶解,得到澄清的溶液。 |
步骤2.___________________ | __________________ |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体___升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com