
| A. | 96倍 | B. | 48倍 | C. | 24倍 | D. | 12倍 |
分析 由方程式可知,生成的混合气体中氨气、水蒸气、二氧化碳的物质的量分数分别为0.5、0.25、0.25,根据$\overline{{M}_{r}}$=Mr1×x1+Mr2×x2+…+Mri×xi计算混合气体平均相对分子质量(其中Mri代表各组分相对分子质量、xi代表各组分物质的量分数),再利用密度之比等于相对分子质量之比计算.
解答 解:由(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O↑+CO2↑可知,生成的混合气体中氨气、水蒸气、二氧化碳的物质的量分数分别为0.5、0.25、0.25,则混合气体的$\overline{{M}_{r}}$=17×0.5+18×0.25+44×0.25=24,因相同条件下气体密度之比等于相对分子质量之比,所以混合气的密度是相同条件下的氢气密度的$\frac{24}{12}$=12倍,故选D.
点评 本题结合铵盐的化学性质,考查了阿伏伽德罗定律推论应用等,难度不大,关键是理解相同条件下气体密度之比等于相对分子质量之比.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol乙酸分子的σ键有7NA | |
| B. | 11.2 L乙烯完全燃烧转移电子数为6.0NA | |
| C. | 88.0g 干冰中含有的电子对数为8.0NA | |
| D. | 1.2g 金刚石中含有的碳碳键数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物 | |
| B. | 酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸和碱的反应 | |
| C. | 燃烧一般都伴随着发光,发热现象,所以有发光.发热的现象就是燃烧 | |
| D. | 醇类物质在空气中燃烧生成CO2 和H2O,甲醇是醇类的一种,所以甲醇在空气中燃烧生成CO2 和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
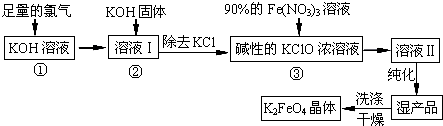
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②⑤①③ | B. | ②④⑤①③ | C. | ④⑤②①③ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com