
【题目】CO2是重要的化工原理,也是应用广泛的化工产品。完成下列计算:
将2.50molCO2气体通过2.00LNaOH溶液中,CO2被完全吸收。取上述溶液20.0mL向该溶液中逐滴加入一定浓度的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
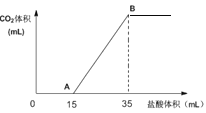
(1)当加入35mL盐酸时,产生二氧化碳的体积为_______mL(标准状况);
(2)吸收二氧化碳后,溶液中两种物质的物质的量之比为:_______。
【答案】560 n(Na2CO3):n(NaHCO3)=3:1
【解析】
CO2气体通过NaOH溶液中,可能发生的反应为:2NaOH+CO2=Na2CO3+H2O、NaOH+CO2=NaHCO3。滴加盐酸后,Na2CO3中发生的反应为:Na2CO3+HCl=NaCl+ NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,若溶液中只含有Na2CO3,则从开始生成气体到反应完全,两个过程消耗的盐酸体积相同,若Na2CO3中混有NaHCO3,则后一阶段消耗的盐酸体积比前一阶段多。现20mL>15mL,所以溶液中的溶质为Na2CO3和NaHCO3的混合物。
(1)2.50molCO2气体通过2.00LNaOH溶液中,生成Na2CO3和NaHCO3共2.50mol,从中取出20.0mL,则Na2CO3和NaHCO3共为![]() =0.0250mol,n(CO2)=n(Na2CO3)+n(NaHCO3)= 0.0250mol,V(CO2)= 0.0250mol×22400mol/L=560mL。答案为:560;
=0.0250mol,n(CO2)=n(Na2CO3)+n(NaHCO3)= 0.0250mol,V(CO2)= 0.0250mol×22400mol/L=560mL。答案为:560;
(2)从反应中可以看出,Na2CO3与HCl反应生成NaHCO3时,消耗盐酸15mL,则生成的NaHCO3再与盐酸反应时,又消耗盐酸15mL,则原混合物中的NaHCO3消耗盐酸5mL,从而得出n(Na2CO3):n(NaHCO3)=c(HCl)×15mL:c(HCl)×5mL= 3:1。答案为:n(Na2CO3):n(NaHCO3)=3:1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是
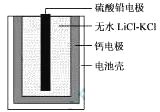
A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某兴趣小组对含有泥沙的粗盐进行提纯实验的流程图,请回答下列问题。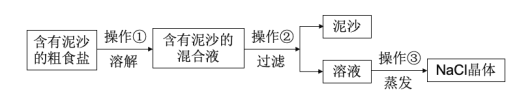
(1)操作②中用到的玻璃仪器是__。
(2)写出操作③中玻璃棒的作用__。
(3)若实验所得NaCl的产率偏低,则可能的原因__(填选项)。
A.过滤时滤纸有破损
B.蒸发时没有用玻璃棒搅拌
C.溶解含泥沙的粗盐时,加入水量不足
D.所得氯化钠晶体没有烘干,带有水分
E.过滤后的滤纸是湿的,纸上的水溶解了一些氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是两个氢原子相互接近时的能量变化图,则有关该图的说法正确的是( )
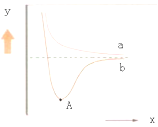
A.y代表两原子之间的核间距
B.x代表体系具有的能量
C.a代表核外电子自旋相反的两个氢原子能量变化
D.A点时表示两原子间形成了稳定的共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
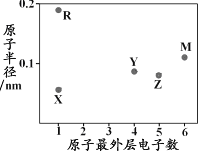
A. R的氧化物含有离子键 B. 最高价含氧酸的酸性:Z<Y
C. M的氢化物常温常压下为气体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
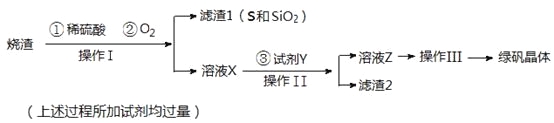 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为__________________________________。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是________________________________。
(4)操作Ⅲ的顺序依次为:_______________、冷却结晶、过滤 、__________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________。
②该同学设计的下列滴定方式,最合理的是____________(夹持部分略去)(填字母序号)。
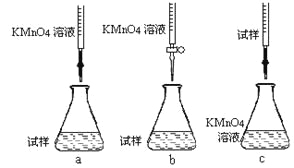
③滴定时发生反应的离子方程式为:_______________________________________。
④判断此滴定实验达到终点的方法是_____________________________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为( )
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为( )
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量
D.N2、H2、NH3分子数比为1∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com