
| A. | 干燥的Cl2和氯水均能使鲜花褪色 | |
| B. | SiO2具有导电性,可用于制造半导体材料 | |
| C. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
分析 A.氯气与水反应生成的次氯酸具有漂白性;
B.二氧化硅为绝缘体;
C.加入氯化钡产生不溶于稀硝酸的白色沉淀的离子可能为银离子或者硫酸根离子;
D.高锰酸钾具有强的氧化性,能够氧化二价铁离子和二氧化硫.
解答 解:A.氯气与水反应生成的次氯酸具有漂白性,鲜花中含有水,所以干燥的Cl2和氯水均能使鲜花褪色,故A正确;
B.二氧化硅为绝缘体,不导电,用于制造半导体材料为硅,故B错误;
C.加入氯化钡产生不溶于稀硝酸的白色沉淀的离子可能为银离子或者硫酸根离子,故C错误;
D.高锰酸钾具有强的氧化性,能够氧化二价铁离子和二氧化硫,本身被还原而褪色,体现Fe2+、SO2的还原性,故D错误;
故选:A.
点评 本题考查了元素化合物知识,明确氯气、次氯酸、二氧化硅、硅、二氧化硫的性质是解题关键,注意离子检验的严密性,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| Ⅰ | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| Ⅱ | 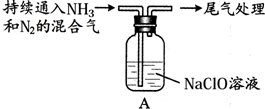 | 液面上方出现白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子 | |
| B. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| C. | 标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时铅蓄电池负极电池反应 PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 充电时蓄电池阴极电极反应 PbSO4+2e-═Pb+SO42- | |
| C. | 用铅蓄电池来电解CuSO4溶液,要生成1.6g Cu,则该电池内部要消耗0.025mol H2SO4 | |
| D. | 铅蓄电池充电时,若要使3.03kg PbSO4转变为Pb和PbO2,则需要通过20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
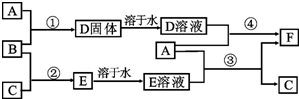 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
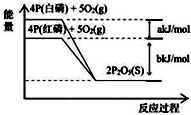
| A. | 4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol | |
| B. | 4P(红磷)+5O2(g)═2P2O5(S);△H2=-(b)kJ/mol | |
| C. | 4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol | |
| D. | P(白磷)═P(红磷);△H4=+(a)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com