
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |

分析 Ⅰ.已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
②N2(g)+2O2(g)=2NO2(g)△H2
③H2O(l)=H2O(g)△H3
根据盖斯定律,①-②+③×2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);
Ⅱ.(1)A.根据v=$\frac{△c}{△t}$计算v(CH4),再根据速率之比等于化学计量数之比计算v(NO2);
B.T1℃时,40min反应处于化学平衡状态,可知参加反应甲烷为0.5mol-0.1mol=0.4mol,再计算CH4的转化率;
C.T2℃时,反应在40min、50min时甲烷均为0.15mol,则40min处于平衡状态;
D.温度越高,反应速率越快,相同时间内参加反应的甲烷越多;
(2)前10min内,温度T2℃时参加反应的甲烷更多,故温度T2>T1,而平衡时温度T2℃时甲烷的物质的量更大,说明升高温度平衡向逆反应移动,正反应为放热反应;
(3)T1℃时,平衡时甲烷为0.1mol,则:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)
开始(mol):0.5 1.2 0 0 0
转化(mol):0.4 0.8 0.4 0.4 0.8
平衡(mol):0.1 0.4 0.4 0.4 0.8
再根据平衡常数表达式K=$\frac{c({N}_{2})×c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$计算;
(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2,瞬间甲烷的物质的量变为0.2mol,而后平衡向正反应方向移动,甲烷的物质的量减小,但到达新平衡时甲烷的物质的量大于0.1mol;
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y为五氧化二氮,石墨I上是二氧化氮失去电子,与硝酸根离子反应生成五氧化二氮,石墨II上是氧气获得电子,与五氧化二氮获反应生成硝酸根.
解答 解:Ⅰ.已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
②N2(g)+2O2(g)=2NO2(g)△H2
③H2O(l)=H2O(g)△H3
根据盖斯定律,①-②+③×2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),则△H=△H1-△H2+2△H3,
故答案为:△H1-△H2+2△H3;
Ⅱ(1)A.前10min内v(CH4)=$\frac{\frac{0.5mol-0.35mol}{2L}}{10min}$=0.0075mol/(L.min),速率之比等于化学计量数之比,则v(NO2)=2v(CH4)=0.015mol/(L.min),故A错误;
B.T1℃时,40min反应处于化学平衡状态,可知参加反应甲烷为0.5mol-0.1mol=0.4mol,CH4的转化率为$\frac{0.4mol}{0.5mol}$×100%=80%,故B正确;
C.T2℃时,反应在40min、50min时甲烷均为0.15mol,则40min处于平衡状态,故C正确;
D.前10min内T2℃时参加反应的甲烷越多,反应速率快,故温度T1<T2,故D错误,
故选:BC;
(2)前10min内,温度T2℃时参加反应的甲烷更多,故温度T2>T1,而平衡时温度T2℃时甲烷的物质的量更大,说明升高温度平衡向逆反应移动,正反应为放热反应,故平衡常数:K(T1)>K(T2),△H<0,
故答案为:>;<;由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热;
(3)T1℃时,平衡时甲烷为0.1mol,则:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)
开始(mol):0.5 1.2 0 0 0
转化(mol):0.4 0.8 0.4 0.4 0.8
平衡(mol):0.1 0.4 0.4 0.4 0.8
则平衡常数K=$\frac{c({N}_{2})×c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$=$\frac{\frac{0.4}{2}×\frac{0.4}{2}×(\frac{0.8}{2})^{2}}{\frac{0.1}{2}×(\frac{0.4}{2})^{2}}$=3.2,
故答案为:3.2;
(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2,瞬间甲烷的物质的量变为0.2mol,而后平衡向正反应方向移动,甲烷的物质的量减小,但到达新平衡时甲烷的物质的量大于0.1mol,重新达到平衡过程中n(CH4)随时间变化的曲线的变化趋势: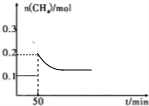 ,
,
故答案为: ;
;
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y为五氧化二氮,石墨I上是二氧化氮失去电子,与硝酸根离子反应生成五氧化二氮,石墨II上是氧气获得电子,与五氧化二氮获反应生成硝酸根,石墨I上电极反应式为:NO2-e-+NO3-=N2O5,
故答案为:NO2-e-+NO3-=N2O5.
点评 本题考查化学平衡计算、化学平衡影响因素、反应热计算、电极反应式书写等,需要学生具备扎实的基础与灵活运用知识的能力,难度中等.


科目:高中化学 来源: 题型:解答题
| 金属离子 | 完全沉淀pH |
| Fe2+ | 9.7 |
| Mg2+ | 12.4 |
| Fe3+ | 3.2 |
| Al3+ | 5.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离常数先增大后减小 | |
| B. | 当氨水和甲酸溶液体积相等时,c(HCOO-)=c(NH4+) | |
| C. | c(NH3•H2O)与c(NH4+)之和始终保持不变 | |
| D. | $\frac{c(N{{H}_{4}}^{+})c(HCO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)c(HCOOH)}$始终保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com