
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是()
| A. | 9:4 | B. | 1:1 | C. | 7:6 | D. | 6:7 |
| 有关混合物反应的计算. | |
| 专题: | 等量代换法. |
| 分析: | 根据2Na2O2+2CO2=2Na2CO3+O2,可知混合物在常温下跟足量的Na2O2固体反应生成固体为Na2CO3, 1molNa2O2生成1molNa2CO3,质量增加28g,恰好为CO的质量,以此判断原混合物中气体的质量之比. |
| 解答: | 解:由反应2Na2O2+2CO2=2Na2CO3+O2,可知混合物在常温下跟足量的Na2O2固体反应生成固体为Na2CO3, 1molNa2O2生成1molNa2CO3,质量增加28g,恰好为CO的质量, 固体增重14g,说明混合气体中CO为14g,则O2为26g﹣14g=12g, 所以原混合气体中O2和CO的质量比为12g:14g=6:7, 故选D. |
| 点评: | 本题考查混合物的计算,题目难度不大,注意从Na2O2生成Na2CO3质量的变化判断反应的规律,此为解答该题的关键. |


科目:高中化学 来源: 题型:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
 (1)反应需在50℃~60℃的温度下进行,图中给反应物加热的方法是水浴加热,
(1)反应需在50℃~60℃的温度下进行,图中给反应物加热的方法是水浴加热,
其优点是_____ ___和_____  ___;
___;
(2)在配制混合酸时应将__________加入到________中去;
(3)该反应的化学方程式是________________________________;反应类型:
(4)由于装置的缺陷,该实验可能会导致的不良后果是______ __.
(5)反应完毕后,除去混合酸,所得粗产品用如下操作精制:
①蒸馏 ②水洗 ③用干燥剂干燥 ④用10%NaOH溶液洗 ⑤水洗
正确的操作顺序是 。
A.①②③④⑤ B.②④⑤③① C.④②③①⑤ D.②④①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离于浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为
(填编号)。
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+) c(OH-)。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”),混合后溶液中的各离子浓度的大小关系为
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2②Na2O③Na2CO3④NaCl()
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ①=②>③>④ | D. | ①=②>③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碱金属的叙述中,正确的是()
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属与水反应均漂浮在水面上 | |
| C. | 碱金属在空气中加热均可生成多种氧化物 | |
| D. | 碱金属的硬度小、密度小、熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
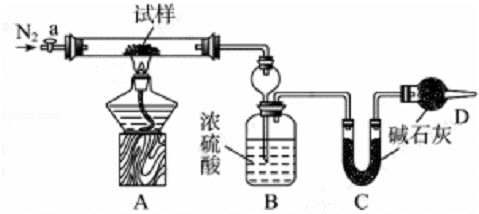
实验过程:
Ⅰ.按图组装仪器,检查装置的气密性;
Ⅱ.将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
Ⅲ.关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为,.
(2)装置B的作用为.装置C的作用为.
(3)实验过程中通入N2的目的为.
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是bce(填选项字母)
| 序号 | a | b | c | d | e |
| 数据 | m1,m2,m3 | m2,m3,m4,m5 | m1,m2,m4 | m1,m4,m5 | m1,m3,m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:×100%(若不能,此问不作答.)
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
⑴下图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
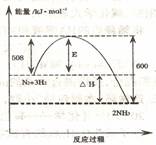
①写出氮气与氢气合成氨的热化学反应方程式: 。
②对于合成氨的反应下列说法正确的是 (填编号)。
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2
D.该反应属于人工固氮
⑵现在普遍应用的工业合成氨的方法为N2+3H2 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A.使用的更高效催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
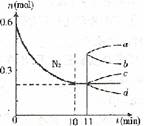
②若在某温度下,2L的密闭容器中发生N2+3H2 2NH3的反应,下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)= 。
2NH3的反应,下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)= 。
从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为 。
A. a B.b C.c D.d
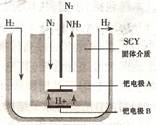
⑶随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质里,用吸附在它内外表面上的金属钯多晶薄膜作电极,实现了常压、570℃条件下高转化率的电解法合成氮(装置如右上图)。则钯电极上的电极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com