
| 578 |
| 2 |
| 1.12 |
| 22.4 |
| 578 |
| 2 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃、101kPa 下,Na2O2(s)+2 Na(s)=2Na2O(s)△H=-317kJ/mol |
| B、①和②生成等物质的量的产物,转移电子数不同 |
| C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D、①和②产物的阴阳离子个数比不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
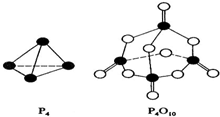
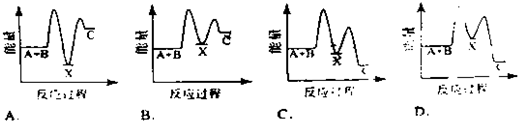
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH固体 |
| C、MgCl2固体 |
| D、NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸和氯水用棕色试剂瓶保存 |
| B、硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C、常温下铁和铂都不溶于浓硝酸 |
| D、SO2和Na2SO3溶液都能使氯水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com