
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含氯原子数目为0.4NA | |
| B. | 1 mol羟基(-OH)中含电子的数目为10NA | |
| C. | 1mol苯乙烯( )中含碳碳双键数为4NA )中含碳碳双键数为4NA | |
| D. | 2.8g乙烯和环丙烷的混合气体中含原子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积气体所含原子个数相同 | |
| B. | 标准状况下1摩尔H2SO4的体积约为22.4 L | |
| C. | 同温同压下,相同体积的H2、O2,其质量比为1:16 | |
| D. | 1摩尔的气体只有在标准状况下才能是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | B. | 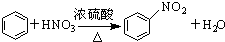 | ||
| C. | 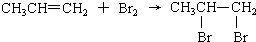 | D. | HCl+AgNO3═AgCl↓?+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com