
分析 (1)①纯碱为碳酸钠、烧碱为氢氧化钠、碱式碳酸铜是碱式盐;
②电解质不一定导电,是熔融状态或水溶液中电离导电;
③碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物;
④浓硫酸在常温下使铁或铝钝化;
⑤同种元素组成的不同单质为同素异形体;
⑥质子数相同,中子数不同的同种元素的不同原子互称同位素;
⑦依据周期表结构分析,周期表中有七个周期,16个族;
(2)根据质量数=质子数+中子数,计算X的质子数.由阴离子Xn-可知X元素的气态氢化物化学式为HnX,根据n=$\frac{m}{M}$计算氢化物HnX的物质的量,结合化学式计算含有的质子的物质的量;
(3)①熔融硫酸氢钾电离生成钾离子和磷酸氢根离子;
②小苏打和过量石灰乳反应生成碳酸钙、氢氧化钠和水;
(4)①根据M=ρVm计算混合气体的平均摩尔质量,设O2和CH4物质的量分别为xmol、ymol,利用平均摩尔质量列方程计算即可;
②化合物中元素的化合价代数和为零,据此计算X元素的化合价.再利用最高正化合价+|最低负化合价|=8,计算X元素在气态氢化物中的化合价;
(5)类似氯化铝与氢氧化钠溶液反应,根据氯化铝与氢氧化钠的反应书写方程式;
(6)根据硅酸盐化学式可表示为活泼金属氧化物•金属氧化物•非金属氧化物•水进行解答.
解答 解:(1)①纯碱、碱式碳酸铜是盐类物质,烧碱是碱,故①错误;
②电解质不一定都能导电,只有在熔融状态或水溶液中导电,如熔融氯化钠导电、固体氯化钠不导电,故②错误;
③碱性氧化物一定都是金属氧化物,酸性氧化物不一定都是非金属氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,故③错误;
④冷的浓硫酸可用铝制容器储存,是因为常温下铝在浓硫酸中发生钝化,能说明常温下冷的浓硫酸可与铝反应,故④正确;
⑤O2和 O3为同素异形体,H2和D2,是同种物质,H218O和D216O不是单质,故⑤错误,
⑥H,D,T互为同位素,HD是单质不是原子,故⑥错误;
⑦元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行,故⑦正确;
故答案为:④⑦;
(2)阴离子Xn-含中子N个,X的质量数为A,所以X的质子数为A-N,
由阴离子Xn-可知X元素的气态氢化物化学式为HnX,所以1个HnX分子中含有的质子数为A-N+n,
氢化物HnX的摩尔质量为(A+n)g/mol,
mgX元素的气态氢化物中含质子的物质的量$\frac{mg}{(A+n)g/mol}$×(A-N+n)=$\frac{m}{A+n}$(A-N+n)mol,
故答案为:$\frac{m}{A+n}$(A-N+n)mol;
(3)①熔融硫酸氢钾电离生成钾离子和磷酸氢根离子,电离方程式为KHSO4=K++HSO4-,
故答案为:KHSO4=K++HSO4-;
②小苏打和过量石灰乳反应生成碳酸钙、氢氧化钠和水,离子方程式为Ca(OH)2+HCO3-=CaCO3↓+H2O+OH-,
故答案为:Ca(OH)2+HCO3-=CaCO3↓+H2O+OH-;
(4)①混合气体在标准状况下的密度为1.25g/L,则混合气体的平均摩尔质量为:1.25g/L×22.4L/mol=28g/mol,
设CH4和O2物质的量分别为xmol、ymol,
则:$\frac{16x+32y}{x+y}$=28,
整理可得:x:y=1:3,
所以混合气体中CH4和O2的体积比为1:3,
故答案为:28g/mol;1:3;
②令X元素的化合价为a,化合物HnXO2n-2中元素的化合价代数和为零,则:1×n+a+(2n-2)×(-2)=0 解得,a=3n-4
最高正化合价+|最低负化合价|=8,所以氢化物中化合价为最高正化合价-8=3n-4-8=3n-12,
故答案为:3n-12;
(5)同主族元素化学性质相似,因此类比氯化铝与氨水的反应可得氯化稼与氨水反应的方程式,反应的化学方程式为GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓,
故答案为:GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓;
(6)将(NaAlSi3O8)改写为氧化物形式为Na2O•Al2O3•6SiO2;
故答案为:Na2O•Al2O3•6SiO2.
点评 本题考查了物质性质、元素周期表、原子结构和离子结构、元素化合价计算、物质的量计算应用等知识点,知识点较多,题目难度中等.


科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:推断题
I.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
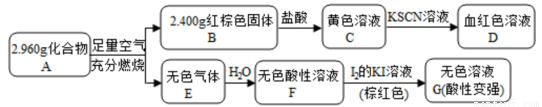
请回答:
(1)A的化学式为__________。A煅烧生成B和E的化学方程式为 。
(2)溶液C可溶解铜片,反应的离子方程式为 ,例举该反应的一个实际应用是____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g/L),该气体分子的电子式为____________。该反应的离子方程式为______________。
II.某同学用副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(1) FeCl3与H2S反应的离子方程式为________________
(2) 电解池中H+再阴极放电产生H2,阳极的电极反应为____________
(3) 综合分析实验II的两个反应,可知该实验有两个显著优点:①H2S的原子利用率100%;②________________
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
下列各组中的两种物质作用时,反应条件(温度?反应物用量比)改变,不会引起产物的种类改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.NaHCO3和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
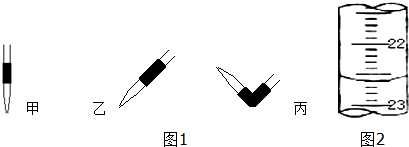
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
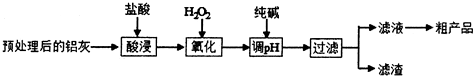
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 2.8 |
| A13+ | 3.4 | 4.7 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
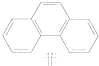
| A. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| B. | 分子式为C8H10,且属于芳香族化合物的同分异构体只有3种 | |
| C. | 菲的结构简式如右图,它与硝酸反应,所得一硝基取代物有5种 | |
| D. | 甲苯苯环上的一个氢原子被一C3H7取代,所得有机产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 离子 | Cu2- | Al3+ | H+ | Cl- | SO42- |
| c(mol/L) | 1 | 1 | 2 | 3 | a |
| A. | 电路中共转移0.9mol电子 | B. | 铝元素以Al(OH)3的形式存在 | ||
| C. | 阴极质量增加3.2g | D. | a=2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
将15mL 2mol/LNa2CO3溶液逐滴加入到40mL 1.5mol/LMCln盐溶液中,恰好将溶液中的Mn+完全沉淀为碳酸盐,则MCln中n值是()
A.4 B.3 C.2 D.l
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| B. | Y元素最高价氧化物对应的水化物化学式为H2YO4 | |
| C. | 原子半径由大到小的顺序为Z>Y>W | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com