

分析 根据晶胞结构图知,以最中心钙离子为例,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,由于晶胞沿一个方向拉长,所以上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离,所以1个Ca2+周围距离最近的C22-有4个,据此答题.
解答 解:根据晶胞结构图知,以最中心钙离子为例,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,由于晶胞沿一个方向拉长,所以上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离,所以1个Ca2+周围距离最近的C22-有4个,
故答案为:4.
点评 本题考查晶胞结构中配位数个数判断,注意该晶胞中是长方体而不是正方体,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| C. | 日本福岛核电站爆炸时释放的两种放射性核素131I与137Cs(铯)的中子数相等 | |
| D. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2C2O4溶液中,2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等体积等物质的量浓度的NaCl和NaClO溶液,两份溶液中离子总数相比前者大 | |
| D. | 0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| C. | 0.10 mol•L-1 NaHCO3溶液加水稀释后,n (H+)与n (OH-)的乘积变大 | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合溶液显碱性:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
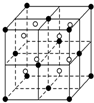 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com