
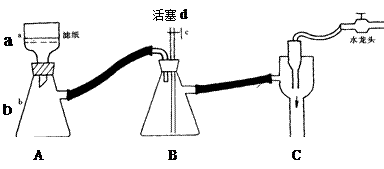
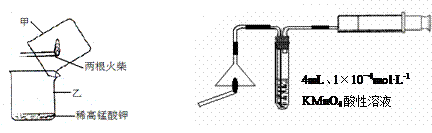

|
|
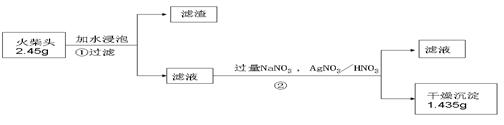
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
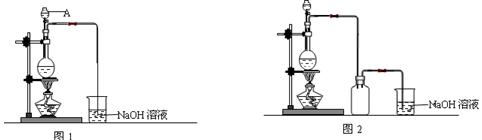
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
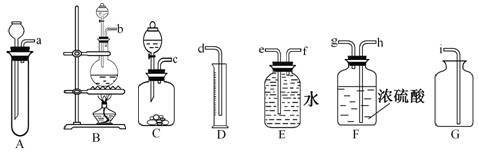
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
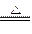 Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)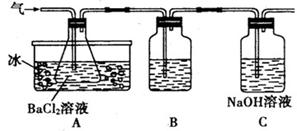
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 | C.逸出SO3气体 | D.逸出SO2气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
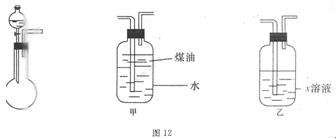
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用铝粉与氧化铁混合加热进行铝热反应。 |
| B.将蔗糖溶于水,加热几分钟后再加入少量新制的Cu(OH)2就可实现将蔗糖水解,并用新制的Cu(OH)2检验蔗糖的水解产物 |
| C.只用溴的四氯化碳溶液就能鉴别乙烷与乙烯 |
| D.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com