

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.6 | 47.5 | 53.8 | 61.3 | 70.5 | 75.4 | 71.1 | 60.5 |
分析 实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,废液过滤得到滤渣Ⅰ沉淀PbSO4,滤液中加入氧化锌或氢氧化锌调节溶液PH,且不引入锌的杂质,过滤得到氢氧化锌,加入稀硫酸溶解且抑制硫酸锌的水解,通过蒸发浓缩,冷却结晶,过滤洗涤干燥得到硫酸锌晶体;
(1)装置图可知为吸滤瓶;
(2)上述分析可知滤渣Ⅰ是铅和硫酸反应生成的硫酸铅白色沉淀,X是用来调节溶液PH使锌离子全部沉淀且不引入新的杂质;
(3)滤渣加入稀硫酸溶解,溶解过程中加入的稀硫酸的作用是制备硫酸锌,抑制锌离子的水解;
(4)溶液中得到溶质晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤干燥得到;
(5)酒精洗涤晶体会减少晶体的损失.
解答 解:实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,废液过滤得到滤渣Ⅰ沉淀PbSO4,滤液中加入氧化锌或氢氧化锌调节溶液PH,且不引入锌的杂质,过滤得到氢氧化锌,加入稀硫酸溶解且抑制硫酸锌的水解,通过蒸发浓缩,冷却结晶,过滤洗涤干燥得到硫酸锌晶体;
(1)实验过程中多次用到如图所示的过滤装置,仪器a的名称依据装置图可知为抽滤瓶,故答案为:抽滤瓶;
(2)上述分析可知滤渣Ⅰ是铅和硫酸反应生成的硫酸铅白色沉淀,X是用来调节溶液PH使锌离子全部沉淀且不引入新的杂质,可以是ZnO或Zn(OH)2,
故答案为:PbSO4;ZnO或Zn(OH)2;
(3)滤渣加入稀硫酸溶解,溶解过程中加入的稀硫酸的作用是制备硫酸锌,抑制锌离子的水解,故答案为:制备ZnSO4并抑制ZnSO4水解;
(4)溶液中得到溶质晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤干燥得到,结晶的操作为蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(5)硫酸锌不溶于酒精,酒精易挥发,用酒精进行洗涤的原因是酒精洗涤晶体会减少晶体的损失,故答案为:减少硫酸锌晶体的损失,容易干燥.
点评 本题综合考查物质的制备、分离、提纯等知识,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解主要目的是得到短链的不饱和烃 | |
| B. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| C. | 煤的气化与液化都是化学变化 | |
| D. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| C. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
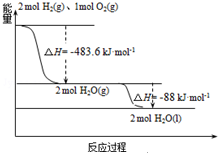 发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:| A. | H2(g)与O2(g)反应生成H2O(g)放热483.6kJ•mol-1 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)=H2O(l)△H=-88kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
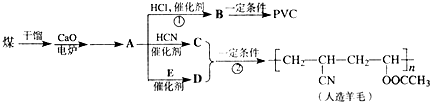
 ,CH2C═CH-CN.
,CH2C═CH-CN.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}点燃}{→}$ SO3$\stackrel{足量氨水}{→}$(NH4)2SO4 | |
| B. | NH3$→_{加热}^{O_{2}/催化剂}$NO$\stackrel{O_{2}}{→}$ NO2 | |
| C. | Fe$→_{加热}^{少量Cl_{2}}$ FeCl2$→_{溶液}^{NaOH溶液}$Fe(OH)2 | |
| D. | Al$→_{溶液}^{NaOH溶液}$ NaAlO2$\stackrel{足量盐酸}{→}$Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com