
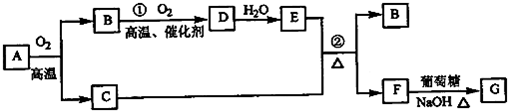
 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O, CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;  2SO3
2SO3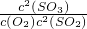 =
=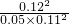 =23.8(l/mol)
=23.8(l/mol) 2SO3
2SO3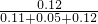 =0.429,
=0.429,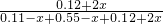 =0.320,
=0.320, CuSO4+SO2↑+2H2O,从平衡移动的角度计算平衡时各物质的浓度,进而计算化学平衡常数以及判断各物质的浓度的变化.
CuSO4+SO2↑+2H2O,从平衡移动的角度计算平衡时各物质的浓度,进而计算化学平衡常数以及判断各物质的浓度的变化.

科目:高中化学 来源: 题型:
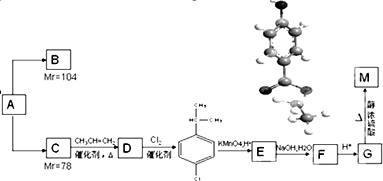


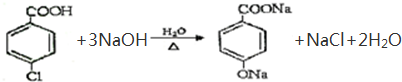

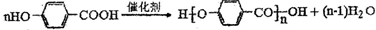
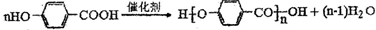
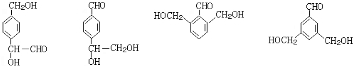

查看答案和解析>>
科目:高中化学 来源:同步题 题型:推断题
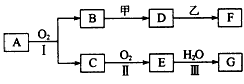
查看答案和解析>>
科目:高中化学 来源:河南省同步题 题型:填空题
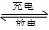 VO2++ 2H++V2+。充电过程中,H+向 ___________ 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。
VO2++ 2H++V2+。充电过程中,H+向 ___________ 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。 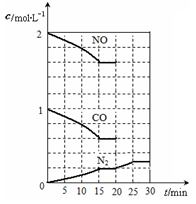
查看答案和解析>>
科目:高中化学 来源:山西省模拟题 题型:填空题
 VO2++ 2H++V2+。充电过程中,H+向 ___________ 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。
VO2++ 2H++V2+。充电过程中,H+向 ___________ 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。 
查看答案和解析>>
科目:高中化学 来源:河南省模拟题 题型:填空题
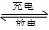 VO2++ 2H++V2+。充电过程中,H+向 ___________ 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。
VO2++ 2H++V2+。充电过程中,H+向 ___________ 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com