
| ���� |

| c2(CO2)?c(N2) |
| c2(NO)?c2(CO) |
| ��n |
| V |
| 0.1mol |
| 2L |
| ��C |
| ��t |
| 0.05mol/L |
| 2s |
| 1 |
| 2 |
| c2(CO2)?c(N2) |
| c2(NO)?c2(CO) |
 ��
�� ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
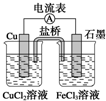 ��ͼ��ʾΪijԭ��صĽṹʾ��ͼ������˵������ȷ���ǣ�������װ���ñ���KCl��Һ���������ɵĶ�������������
��ͼ��ʾΪijԭ��صĽṹʾ��ͼ������˵������ȷ���ǣ�������װ���ñ���KCl��Һ���������ɵĶ�������������| A����ԭ��ص��ܷ�ӦʽΪ2Fe3++Cu�T2Fe2++Cu2+ |
| B���õ�ع���ʱ��Cu2+�ڵ缫�ϵõ����ӣ�������ԭ��Ӧ |
| C�����ô˵�ص�ⱥ���Ȼ�����Һ��ȡCl2����ͭ�缫����������6.4 gʱ���������������Ϊ2.24 L������Ϊ��״���� |
| D����ع��������У�������ͭ�缫��������������ʯī�缫 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
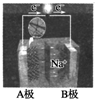 ���գ����������о�С��ͨ����ͬŬ�����������۵������ӣ�ͬʱʹ�����������̺�﮲������缫�������������ӳ���أ��乤��ʾ��ͼ��ͼ��ʾ�����ڸõ�ص�˵������ȷ���ǣ�������
���գ����������о�С��ͨ����ͬŬ�����������۵������ӣ�ͬʱʹ�����������̺�﮲������缫�������������ӳ���أ��乤��ʾ��ͼ��ͼ��ʾ�����ڸõ�ص�˵������ȷ���ǣ�������| A���ŵ�ʱA�������� |
| B���ŵ�ʱNa+���ƶ� |
| C�����ʱ�ǽ���ѧ��ת��Ϊ���� |
| D�����ʱB��Ϊ����������������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
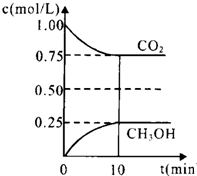 ������̼����������ЧӦ������Ҫ���ʣ����ܼ��ţ���Ч������Դ���ܹ����ٶ�����̼���ŷţ�
������̼����������ЧӦ������Ҫ���ʣ����ܼ��ţ���Ч������Դ���ܹ����ٶ�����̼���ŷţ�| n(CH3OH) |
| n(CO2) |
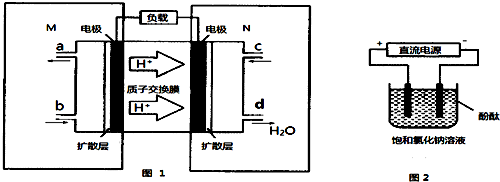
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ��Ҫ�� | �Լ������� |
| ����Na2SO4��Һ��NaCl��Һ | |
| ֤��������Һ������ | |
| ������˿Χ���ʹ���Χ�� | |
| ��������ˮ���Ƿ��е��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��̼�����ƿ���ʳƷ���ɼ���2NaHCO3
| ||||
| B��������������ʢװ��Һ��2Al+2OH-+2H2O�T2AlO2-+3H2�� | ||||
| C������������������Cl2+H2O�T2H++Cl-+ClO- | ||||
| D���������ƿ����ں�����ߣ�2Na2O2+2CO2�TNa2CO3+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������������ϡ���3Fe2++4H++NO3-�T3Fe3++NO��+3H2O |
| B����NaAlO2��Һ��ͨ������CO2��AlO2-+CO2+2H2O�TAl��OH��3��+HCO3- |
| C���ù�����ˮ���չ�ҵβ���е�SO2��2NH3?H20+SO2�T2NH4++SO32-+H2O |
| D��������Һ�е���Ba��OH��2��ҺʹSO42-ǡ����ȫ������2Ba2++3OH-+Al3++2SO42-�T2BaSO4��+Al��OH��3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com