
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4V}$ | |
| C. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω | |
| D. | 上述溶液中再加入1.5VmL同物质的量浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
分析 A.根据ω=$\frac{溶质质量}{溶液质量}$×100%计算;
B.根据c=$\frac{{n}_{溶质}}{{V}_{溶液}}$计算判断;
C.水的密度大于氨水的密度,所以等体积时,水的质量大于氨水的质量,这样混合后,所得溶液浓度小于0.5ω,根据公式溶质质量分数═$\frac{溶质质量}{溶液质量}$×100%计算.
D.加入1.5VmL同物质的量浓度稀盐酸,盐酸的物质的量大,溶液显酸性,以此判断离子浓度大小.
解答 解:A.氨气溶于水,主要以NH3•H2O存在,但仍然以NH3作为溶质,ω=$\frac{溶质质量}{溶液质量}$×100%=$\frac{\frac{V(N{H}_{3})×M}{{V}_{m}}}{ρ{V}_{溶液}}$×100%=$\frac{17a}{22.4ρV}$×100%,故A错误;
B.c=$\frac{{n}_{溶质}}{{V}_{溶液}}$=$\frac{\frac{aL}{22.4L/mol}}{1{0}^{-3}VL}$=$\frac{1000a}{22.4V}$mol/L,故B正确;
C.氨水密度小于水的密度,则溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%=$\frac{ρVw%}{ρV(氨水)+m(水)}$×100%=$\frac{ρ(氨水)Vω}{ρ(氨水)V+ρ(水)V}$<0.5ω,故C错误;
D.盐酸的物质的量大于氨水的物质的量,所以该溶液呈酸性,溶液中氢离子浓度大于氢氧根离子的浓度,氯离子的浓度大于铵根离子的浓度,所以大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握相关计算公式、溶液酸碱性判断为解答的关键,侧重分析与计算能力的考查,注意物质的量浓度、质量分数的关系,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应 | B. | 放热反应 | C. | 化合反应 | D. | 吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
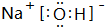 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
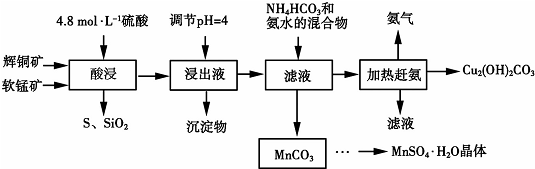
| 物质 | Cu(OH)2 | Fe(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 8.3 | 1.4 |
| 沉淀完全pH | 13 | 14 | 9.8 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水湿润的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 可用酸式滴定管准确量取10.00mLKMnO4溶液 | |
| C. | 在中和热测定实验中,不能用温度计来搅拌溶液 | |
| D. | 将乙烯通入酸性高锰酸钾溶液,可检验乙烯的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH是氧化剂 | B. | C2H5OH发生氧化反应 | ||
| C. | CrO3是还原剂 | D. | H2SO4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com