
| A. | 氢氧化钠 | B. | 亚硫酸钠 | C. | 氯化亚铁 | D. | 苯酚 |
分析 空气中的成分为氮气、氧气、二氧化碳、水蒸气、稀有气体等,不是因为空气中的氧气而变质,则选项中物质不具有还原性,不能被氧化,是物质和二氧化碳反应变质,以此来解答.
解答 解:A.NaOH易潮解,与空气的二氧化碳反应而变质,故A选;
B.亚硫酸钠能被氧化生成硫酸钠,因为空气中的氧气而变质,2Na2SO3+O2=2Na2SO4,故B不选;
C.氯化亚铁具有还原性,和空气中氧气反应而变质,故C不选;
D.苯酚易和空气中氧气反应变为粉红色,故D不选;
故选A.
点评 本题考查氧化还原反应的应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意氧气参加的反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 长期大量使用(NH4)2SO4化肥会使土壤酸化,而使用尿素[CO(NH2)2]则不会改变土壤酸碱性 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
化学与能源、环境、生产、生活密切相关。下列说法不正确的是
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.可利用工业生产产生的二氧化碳制造全降解塑料
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

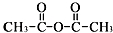
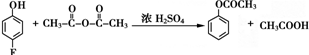 .
. 、
、
 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

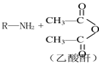 →R-NHCOCH2+CH2COOH(R为烃基)
→R-NHCOCH2+CH2COOH(R为烃基) (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子. →B 的反应类型是取代反应.
→B 的反应类型是取代反应. .
.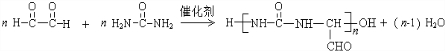 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
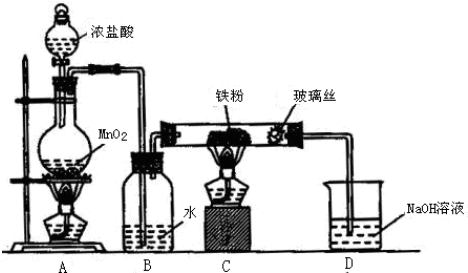
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(C2O42-)<0.64c(CO32-) | B. | c(CO32-)>1.56c(C2O42-) | ||
| C. | c(C2O42-)<1.56c(CO32-) | D. | c(C2O42-)>0.64c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
| N(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
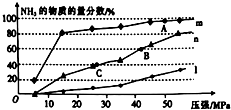
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com