
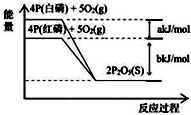
| A. | 4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol | |
| B. | 4P(红磷)+5O2(g)═2P2O5(S);△H2=-(b)kJ/mol | |
| C. | 4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol | |
| D. | P(白磷)═P(红磷);△H4=+(a)kJ/mol |
分析 分析图象可知白磷燃烧,4molP燃烧放热为(a+b)KJ,红磷燃烧,4molP完全燃烧生成五氧化二磷,放出热量bKJ,结合热化学方程式书写方法,标注物质聚集状态和对应反应的焓变判断选项.
解答 解:分析图象可知白磷燃烧,4molP燃烧放热为(a+b)KJ,热化学方程式为:4P(白磷)+5O2(g)═2P2O5(S);△H1=-(a+b)kJ/mol,红磷燃烧,4molP完全燃烧生成五氧化二磷,放出热量bKJ,4P(红磷)+5O2(g)═2P2O5(S);△H2=-bkJ/mol,
A.选项中焓变应为负值,故A错误;
B.红磷燃烧放热bKJ,反应的热化学方程式为:4P(红磷)+5O2(g)═2P2O5(S);△H2=-bkJ/mol,故B正确;
C.选项无物质聚集状态,焓变应为负值,故C错误;
D.白磷变化为红磷过程是放热反应,焓变为负值,故D错误;
故选B.
点评 本题考查了热化学方程式书写,图象的理解应用,注意反应焓变的正负值含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用稀硫酸鉴别SiO2与Al2O3固体 | |
| D. | 用氢氧化钙溶液鉴别Na2CO3和NaHCO3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA | |
| B. | 常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA | |
| C. | 标准状况下,2.24 L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 6.8g熔融态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的Cl2和氯水均能使鲜花褪色 | |
| B. | SiO2具有导电性,可用于制造半导体材料 | |
| C. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量氢氧化钠溶液后产生的浑浊不溶解 | |
| B. | 用pH试纸检验呈弱酸性 | |
| C. | 滴入KSCN溶液后溶液变血红色 | |
| D. | 溶液显浅黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中共发生了1个氧化还原反应 | |
| B. | 反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ | |
| C. | 有胶状物质生成 | |
| D. | 溶液颜色发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的焓变为△H=+(a-b) kJ/mol | |
| B. | 加入催化剂只能减小a而不能改变b的大小 | |
| C. | 加入催化剂可使反应热效应逆转,从而易于进行 | |
| D. | 断裂1molA-A和1molB-B键,放出a kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com