
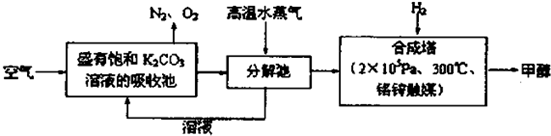
| ||
| ||
| ||


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
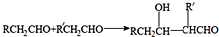
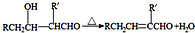
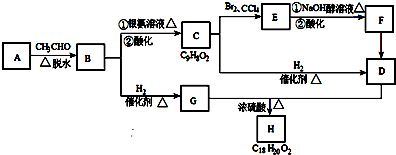
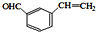
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |
| ② | 20mL 0.2mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 mL |
| B、40mL |
| C、30 mL |
| D、15 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯 | B、丙烯 | C、丁烯 | D、戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+>C12>MnO4- |
| B、Fe3+>Cl2>I2 |
| C、I2>Cl2>Fe3+ |
| D、MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b2 mol?L-1?s-1 | ||
B、
| ||
| C、b mol?L-1?s-1 | ||
| D、db2 mol?L-1?s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com