
”¾ĢāÄæ”æ¼×“¼ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ¼°ÄÜŌ“ĪļÖŹ”£
(1)ĄūÓĆCO2ŗĶH2ŌŚ“߻ƼĮµÄ×÷ÓĆĻĀŗĻ³É¼×“¼£¬·¢ÉśµÄÖ÷ŅŖ·“Ó¦ČēĻĀ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)””¦¤H2=-58 kJ”¤mol-1£¬ŌŚÄ³ĪĀ¶ČŹ±£¬½«1. 0 mol CO Óė2. 0 mol H2³äČė2 LµÄæÕøÖĘæÖŠ£¬·¢ÉśÉĻŹö·“Ó¦£¬ŌŚµŚ5 min Ź±“ļµ½»ÆŃ§Ę½ŗāדĢ¬£¬“ĖŹ±¼×“¼µÄĪļÖŹµÄĮæ·ÖŹżĪŖ10%”£¼×“¼ÅØ¶ČµÄ±ä»ÆדæöČēĶ¼ĖłŹ¾:
CH3OH(g)+H2O(g)””¦¤H2=-58 kJ”¤mol-1£¬ŌŚÄ³ĪĀ¶ČŹ±£¬½«1. 0 mol CO Óė2. 0 mol H2³äČė2 LµÄæÕøÖĘæÖŠ£¬·¢ÉśÉĻŹö·“Ó¦£¬ŌŚµŚ5 min Ź±“ļµ½»ÆŃ§Ę½ŗāדĢ¬£¬“ĖŹ±¼×“¼µÄĪļÖŹµÄĮæ·ÖŹżĪŖ10%”£¼×“¼ÅØ¶ČµÄ±ä»ÆדæöČēĶ¼ĖłŹ¾:

¢Ł“Ó·“Ó¦æŖŹ¼µ½5 min Ź±£¬Éś³É¼×“¼µÄĘ½¾łĖŁĀŹĪŖ________£¬5 min Ź±ÓėĘšŹ¼Ź±ČŻĘ÷µÄŃ¹Ēæ±ČĪŖ______”£
¢Ś5 min Ź±“ļµ½Ę½ŗā£¬H2µÄĘ½ŗā×Ŗ»ÆĀŹ¦Į=______%£¬»ÆŃ§Ę½ŗā³£ŹżK=______”£
¢Ū1 min Ź±µÄv(Õż)(CH3OH)________4 minŹ±v(Äę)(CH3OH ) (Ģī”°“óÓŚ”±”°Š”ÓŚ”±»ņ”°µČÓŚ”±)”£
¢ÜČō½«øÖĘæ»»³ÉĶ¬ČŻ»żµÄ¾ųČČøÖĘ棬ÖŲø“ÉĻŹöŹµŃé£¬Ę½ŗāŹ±¼×“¼µÄĪļÖŹµÄĮæ·ÖŹż________10%(Ģī”°>”±”°<”±»ņ”°=”±)”£
(2)ĻĀĶ¼ŹĒ¼×“¼Č¼ĮĻµē³Ų¹¤×÷µÄŹ¾ŅāĶ¼£¬ĘäÖŠA”¢B”¢D¾łĪŖŹÆÄ«µē¼«£¬CĪŖĶµē¼«”£¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬶ĻæŖK£¬“ĖŹ±A”¢BĮ½¼«ÉĻ²śÉśµÄĘųĢåĢå»żĻąĶ¬”£

¢Ł¼×ÖŠøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ______________________”£
¢ŚŅŅÖŠA¼«Īö³öµÄĘųĢåŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ________”£
¢Ū±ū×°ÖĆČÜŅŗÖŠ½šŹōŃōĄė×ÓµÄĪļÖŹµÄĮæÓė×ŖŅʵē×ÓµÄĪļÖŹµÄĮæ±ä»Æ¹ŲĻµČēĻĀĶ¼£¬ŌņĶ¼ÖŠ¢ŚĻß±ķŹ¾µÄŹĒ____µÄ±ä»Æ£»·“Ó¦½įŹųŗó£¬ŅŖŹ¹±ū×°ÖĆÖŠ½šŹōŃōĄė×ÓĒ”ŗĆĶźČ«³Įµķ£¬ŠčŅŖ____ mL 5. 0 mol”¤L-1 NaOHČÜŅŗ”£

”¾“š°ø”æ0.025 mol”¤L-1”¤min-1 5:6 25 0.59 “óÓŚ < CH3OH-6e-+8OH-=CO32”Ŗ+6H2O 2.24 L Fe2+ 280
”¾½āĪö”æ
£Ø1£©øł¾ŻĢāÄæŹż¾Ż¼ĘĖćČēĻĀ£ŗ
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
ĘšŹ¼£ŗ0.5 1 0
·“Ó¦£ŗx 2x x
Ę½ŗā£ŗ0.5-x 1-2xx
¼×“¼µÄĪļÖŹµÄĮæ·ÖŹżĪŖ10%£¬ĖłŅŌx/(0.5-x+1-2x+x)”Į100%=10%£¬x=0.125mol/L£»
¢Ł“Ó·“Ó¦æŖŹ¼µ½5 min Ź±£¬Éś³É¼×“¼µÄĘ½¾łĖŁĀŹĪŖ0.125/5=0.025mol/(L”¤min)£»Ń¹ĒæÖ®±ČŗĶĘųĢåµÄĪļÖŹµÄĮæ³ÉÕż±Č£¬Ņņ“Ė£¬5 min Ź±ÓėĘšŹ¼Ź±ČŻĘ÷µÄŃ¹Ēæ±ČĪŖ£ŗ£Ø0.5-0.125+1-2”Į0.125+0.125£©”Į2£ŗ£Ø1+2£©=5:6 £»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ5:6”£
¢Ś5 min Ź±“ļµ½Ę½ŗā£¬H2µÄĘ½ŗā×Ŗ»ÆĀŹ¦Į=2”Į0.125/1”Į100%=25%£»“ļĘ½ŗāŹ±CO”¢H2ŗĶCH3OHµÄĪļÖŹµÄĮæÅØ¶Č·Ö±šĪŖ£ŗ0.375mol/L”¢0.75mol/LŗĶ0.125mol/L£¬ĖłŅŌĘ½ŗā³£ŹżK£½0.125/0.375”Į0.752£½0.59£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ25£¬0.59”£
¢Ū·“Ó¦“ļĘ½ŗāµÄĖŁĀŹĶ¼ĻńČēĻĀĶ¼£ŗ
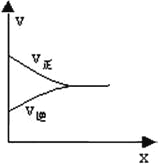
ĖłŅŌ£¬ŌŚ“ļĘ½ŗāĒ°ČĪŅāµćµÄÕż·“Ó¦ĖŁĀŹ“óÓŚČĪŅāµćµÄÄę·“Ó¦ĖŁĀŹ£¬¼“1minŹ±µÄvÕż(CH3OH)£¾4minŹ±vÄę(CH3OH )£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ“óÓŚ”£
¢ÜČō½«øÖĘæ»»³ÉĶ¬ČŻ»żµÄ¾ųČČøÖĘ棬ÖŲø“ÉĻŹöŹµŃ飬Ōņ·“Ó¦·Å³öµÄČČĮæ²»ÄÜÉ¢·¢£¬»įŹ¹ĢåĻµĪĀ¶ČÉĻÉż£¬Õż·“Ó¦·ÅČČ£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāÄęĻņŅĘ¶Æ£¬¼×“¼Ģå»ż·ÖŹż½«¼õŠ”£¬ĖłŅŌŠ”ÓŚ0.1£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ<”£
(2)¢Ł¼×“¼Č¼ĮĻµē³ŲŹĒŌµē³Ų·“Ó¦£¬¼×“¼ŌŚøŗ¼«Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦ĪŖ£ŗCH3OH-6e-+8OH-=CO32”Ŗ+6H2O£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗCH3OH-6e-+8OH-=CO32”Ŗ+6H2O”£
¢Ś¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬶ĻæŖK£¬“ĖŹ±A”¢BĮ½¼«ÉĻ²śÉśµÄĘųĢåĢå»żĻąĶ¬£¬·ÖĪöµē¼«·“Ó¦£¬BĪŖŅõ¼«£¬ČÜŅŗÖŠĶĄė×ÓĪö³ö£¬ĒāĄė×ӵƵ½µē×ÓÉś³ÉĒāĘų£¬ÉčÉś³ÉĘųĢåĪļÖŹµÄĮæĪŖx£¬ČÜŅŗÖŠĶĄė×ÓĪļÖŹµÄĮæĪŖ0.1mol£¬·¢ÉśĮ½²½µē¼«·“Ó¦ĪŖ£ŗ¢ŁCu2++2e©ØTCu£¬0.1mol Cu2+²Ī¼Ó·“Ó¦×ŖŅʵē×Ó0.2 mol£»¢Ś2H++2e-=H2”ü£¬Éś³ÉĒāĘųĪŖx mol£¬Ōņ×ŖŅʵē×Ó2x mol£»Aµē¼«ĪŖŃō¼«£¬ČÜŅŗÖŠµÄĒāŃõøłĄė×ÓŹ§µē×ÓÉś³ÉŃõĘų£¬µē¼«·“Ó¦ĪŖ£ŗ4OH--4e©= O2”ü+2H2O£¬Éś³ÉŃõĘųĪŖx mol£¬×ŖŅʵē×ÓĪŖ4x mol£»øł¾Żµē×ӵƏ§ŹŲŗć¹ęĀÉ£ŗ0.2+2x=4x£¬x=0.1mol£¬ŅŅÖŠA¼«Īö³öµÄĘųĢåŹĒŃõĘųĪļÖŹµÄĮæĪŖ0.1mol£¬ŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ2.24L£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ2.24L”£
¢Ūøł¾Ż×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŗĶ½šŹōŃōĄė×ÓµÄĪļÖŹµÄĮæµÄ±ä»Æ£¬æÉÖŖ£¬ĶĄė×Ó“ÓĪŽµ½Ōö¶ą£¬ĢśĄė×ÓĪļÖŹµÄĮæ¼õŠ”£¬ŃĒĢśĄė×ÓŌö¼Ó£¬¢ŁĪŖFe3+£¬¢ŚĪŖFe2+£¬¢ŪĪŖCu2+£¬ŅĄ¾Ż¢ŚæÉÖŖ£ŗµ±µē×Ó×ŖŅĘĪŖ0.2molŹ±£¬±ūÖŠŃō¼«µē¼«·“Ó¦Cu-2e-![]() Cu2+£¬Éś³ÉCu2+ĪļÖŹµÄĮæĪŖ0.1mol£»Ņõ¼«µē¼«·“Ó¦Fe3++e-
Cu2+£¬Éś³ÉCu2+ĪļÖŹµÄĮæĪŖ0.1mol£»Ņõ¼«µē¼«·“Ó¦Fe3++e-![]() Fe2+£¬ČÜŅŗÖŠÓŠFe3+ĪŖ0.2mol£¬Éś³ÉFe2+ĪŖ0.2mol£¬øł¾ŻĶ¼ĻńæÉÖŖ£¬ČÜŅŗÖŠ¹²ÓŠFe2+ĪŖ0.3mol£»ĖłŅŌøł¾ŻČÜŅŗÖŠ£ŗCu2+ĪŖ0.1mol£¬Fe2+ĪŖ0.3mol£¬Fe3+ĪŖ0.2molæÉÖŖ£¬ŠčŅŖ¼ÓČėNaOHµÄĮæĪŖ1.4mol£¬ĖłŅŌNaOHČÜŅŗµČĢå»żĪŖ:1.4 mol”Ā5.0 moL/L =0.28L=280mL”£×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗFe2+£¬280”£
Fe2+£¬ČÜŅŗÖŠÓŠFe3+ĪŖ0.2mol£¬Éś³ÉFe2+ĪŖ0.2mol£¬øł¾ŻĶ¼ĻńæÉÖŖ£¬ČÜŅŗÖŠ¹²ÓŠFe2+ĪŖ0.3mol£»ĖłŅŌøł¾ŻČÜŅŗÖŠ£ŗCu2+ĪŖ0.1mol£¬Fe2+ĪŖ0.3mol£¬Fe3+ĪŖ0.2molæÉÖŖ£¬ŠčŅŖ¼ÓČėNaOHµÄĮæĪŖ1.4mol£¬ĖłŅŌNaOHČÜŅŗµČĢå»żĪŖ:1.4 mol”Ā5.0 moL/L =0.28L=280mL”£×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗFe2+£¬280”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖĢ½¾æĶā½ēĢõ¼ž¶ŌŠæÓėĻ”ĮņĖį·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬Éč¼ĘČēĻĀ·½°ø:
±ąŗÅ | “æŠæ·Ū | 0. 2 mol”¤L-1ĮņĖįČÜŅŗ | ĪĀ¶Č | ĮņĖįĶ¹ĢĢå |
¢ń | 2. 0 g | 200. 0 mL | 25 ”ę | 0 |
¢ņ | 2. 0 g | 200. 0 mL | 35 ”ę | 0 |
¢ó | 2. 0 g | 200. 0 mL | 35 ”ę | 0. 2 g |
ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
A. ¢ńŗĶ¢ņŹµŃéĢ½¾æĪĀ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ
B. ¢ņŗĶ¢óŹµŃéĢ½¾æŌµē³Ų¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ
C. ·“Ó¦ĖŁĀŹ¢ó>¢ņ>¢ń
D. ŹµŃé¢ń”¢¢ņ”¢¢óµÄ±ä»ÆĶ¼ĻóČēĶ¼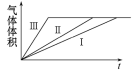
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĻĀĮŠø÷Ķ¼ĒśĻß±ķÕ÷µÄŠÅĻ¢”£µĆ³öµÄ½įĀŪÕżČ·µÄŹĒ
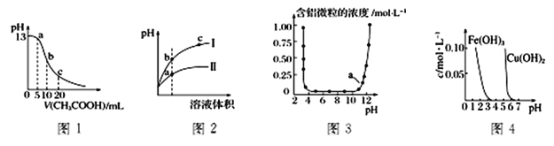
A. Ķ¼1±ķŹ¾³£ĪĀĻĀĻņĢå»żĪŖ10mL0.1 molL-1NaOHČÜŅŗÖŠÖšµĪ¼ÓČė0.1 molL-1CH3COOHČÜŅŗŗóČÜŅŗµÄpH±ä»ÆĒśĻߣ¬Ōņbµć“¦ÓŠ£ŗc(CH3COOH)+c(H+)=c(OH-)
B. Ķ¼2±ķŹ¾ÓĆĖ®Ļ”ŹĶpHĻąĶ¬µÄŃĪĖįŗĶNH4C1ČÜŅŗŹ±”£ČÜŅŗµÄpH±ä»ÆĒśĻߣ¬ĘäÖŠ¢ń±ķŹ¾ŃĪĖį£¬¢ņ±ķŹ¾NH4C1ČÜŅŗ£¬ĒŅČÜŅŗµ¼µēŠŌ:b>c>a
C. Ķ¼3±ķŹ¾µÄŹĒAl3+ÓėOH-·“Ó¦Ź±ŗ¬ĀĮĪ¢Į£ÅØ¶Č±ä»ÆĒśĻߣ¬Ķ¼ÖŠaµćČÜŅŗÖŠ“óĮæ“ęŌŚAl3+
D. ÓÉĶ¼4µĆ³öČō³żČ„Fe2(SO4)3ČÜŅŗÖŠµÄCu2+£¬æɲÉÓĆĻņČÜŅŗÖŠ¼ÓČėŹŹĮæFe2O3£¬µ÷½ŚČÜŅŗµÄpH ÖĮ4×óÓŅ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪļÖŹµÄ·ÖĄąČēĶ¼ĖłŹ¾£ŗ

ÓÉĶ¼ÅŠ¶ĻĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø £©
A.¼×Ķ¼ĖłŹ¾µÄ·ÖĄą·½·ØŹōÓŚŹ÷ד·ÖĄą·Ø
B.ŅŅĶ¼ĖłŹ¾µÄ·ÖĄą·½·ØŹōÓŚ½»²ę·ÖĄą·Ø
C.¼īŠŌŃõ»ÆĪļŅ»¶ØŹĒ½šŹōŃõ»ÆĪļ
D.·Ē½šŹōŃõ»ÆĪļŅ» ¶ØŹĒĖįŠŌŃõ»ÆĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµēÄÜŹĒĻÖ“śÉē»įÖŠÓ¦ÓĆ×ī¹ć·ŗµÄŅ»ÖÖÄÜŌ“”£ĻĀĮŠÓėµēÓŠ¹ŲµÄŠšŹöÖŠ£¬ÕżČ·µÄŹĒ£Ø £©
A.µēÄÜŹōÓŚŅ»“ĪÄÜŌ“
B.ļ®Ąė×Óµē³ŲŹōÓŚŅ»“ĪŠŌµē³Ų
C.»šĮ¦·¢µē½«µēÄܼä½Ó×Ŗ»ÆĪŖČČÄÜ
D.³äµēµē³Ų¹¤×÷Ź±·¢ÉśĮĖŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij¹¤³§µÄ¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠ“óĮæµÄFeSO4”¢½Ļ¶ąµÄCu2+ŗĶÉŁĮæµÄNa+”£ĪŖĮĖ¼õÉŁĪŪČ¾²¢±ä·ĻĪŖ±¦£¬¹¤³§¼Ę»®“ÓøĆ·ĻĖ®ÖŠ»ŲŹÕĮņĖįŃĒĢśŗĶ½šŹōĶ”£

£Ø1£©²½Öč1µÄÖ÷ŅŖ²Ł×÷ŹĒ__________£¬ŠčÓƵ½µÄ²£Į§ŅĒĘ÷³żÉÕ±”¢²£Į§°ōĶāÓŠ________”£
£Ø2£©²½Öč2ÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________________________
£Ø3£©²½Öč3ÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________________________
£Ø4£©²½Öč4ÖŠÉę¼°µÄ²Ł×÷ŹĒ£ŗÕō·¢ÅØĖõ”¢_________”¢¹żĀĖ”¢Ļ“µÓ”¢ŗęøÉ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķĪŖŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬ÓĆ»ÆѧÓĆÓļ»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©»ÆŗĻĪļAŹĒÓÉ¢Ż¢ąĮ½ÖÖŌŖĖŲ¹¹³ÉµÄ£¬ÓƵē×ÓŹ½±ķŹ¾ĘäŠĪ³É¹ż³Ģ______________
£Ø2£©¢Ü”¢¢ßŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖŠ£¬¢ßµÄŌ×ÓŹżÓė¢Ü”¢¢ß¼äµÄ»Æѧ¼üøöŹżÖ®±Č___________________
£Ø3£©¢ŚµÄ×ī¼ņµ„Ēā»ÆĪļÓėŃõĘųæÉŅŌÉč¼Ę³ÉČ¼ĮĻµē³Ų£¬Š“³öŌŚ¼īŠŌĢõ¼žĻĀøŗ¼«µÄµē¼«·½³ĢŹ½_____________________________________
£Ø4£©ÓɱķÖŠŌŖĖŲŠĪ³ÉµÄ³£¼ūĪļÖŹX”¢Y”¢Z”¢M”¢NæÉ·¢ÉśŅŌĻĀ·“Ó¦£ŗ

a”¢¢ŽµÄµ„ÖŹÓė¢ŻµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖ®ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ___________________£»
b”¢MÖŠĖłŗ¬»Æѧ¼üµÄĄąŠĶ___________________________________£»
c”¢MÖŠµÄŃōĄė×ӵļų¶Ø·½·ØŹĒ_______________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠA”¢B”¢C”¢DĖÄÖÖŌŖĖŲ£¬AŌŖĖŲµÄŌ×ÓÓŠČżøöµē×Ó²ć£¬×īĶā²ćÉĻÓŠŅ»øöµē×Ó£ŗBŌŖĖŲ-2¼ŪŅõĄė×ӵĵē×Ó²ć½į¹¹Óėė²Ō×ÓĻąĶ¬£»CŌŖĖŲµÄŌ×ÓŗĖÄŚĪŽÖŠ×Ó£ŗDŌ×ÓŗĖĶāµē×ÓŹż±ČAŌ×ÓŗĖĶāµē×Ó×ÜŹż¶ą6øö”£
£Ø1£©Š“³öA”¢B”¢C”¢DĖÄÖÖŌŖĖŲµÄ·ūŗÅ£ŗA________”¢B________”¢C________”¢D________”£
£Ø2£©Š“³öÓėAµÄµē×Ó²ć½į¹¹ĻąĶ¬µÄĮ½ÖÖĄė×ӵĥė×Ó·ūŗÅ________”¢________”£
£Ø3£©Š“³öBĄė×ӵĵē×ÓŹ½________________£¬DŌ×ӵĽį¹¹Ź¾ŅāĶ¼________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“ÓÅ£ÖĮ¾«ÓĶÖŠĢįČ”µÄČżÖÖ»īŠŌ³É·ÖµÄ½į¹¹¼ņŹ½ČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. aÖŠŗ¬ÓŠ2øöŹÖŠŌĢ¼Ō×Ó(ŹÖŠŌĢ¼Ō×ÓÖøĮ¬ÓŠĖÄøö²»Ķ¬»łĶŵÄĢ¼Ō×Ó)
B. b·Ö×Ó“ęŌŚŹōÓŚ·¼Ļć×å»ÆŗĻĪļµÄĶ¬·ÖŅģ¹¹Ģå
C. c·Ö×ÓÖŠĖłÓŠĢ¼Ō×ÓæÉÄÜ“¦ÓŚĶ¬Ņ»Ę½Ćę
D. a”¢b”¢c¾łÄÜ·¢Éś¼Ó³É·“Ó¦”¢Č”“ś·“Ó¦”¢¼Ó¾Ū·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com