
反应A+2B===3C+2D,在不同条件下的反应速率如下,其中最快的是( )
A.v(A)=0.3 mol·(L·s)-1
B.v(B)=0.9 mol·(L·s)-1
C.v(C)=0.6 mol·(L·s)-1
D.v(D)=0.8 mol·(L·s)-1
科目:高中化学 来源: 题型:
CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用力分别是( )
A.化学键,化学键
B.化学键,分子间作用力
C.分子间作用力,化学键
D.分子间作用力,分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填选项字母)。
A.NaOH B.Zn
C.Fe D.NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:

(1)该反应的化学方程式是___________________________。
(2)反应起始至t,Y的平均反应速率是_________________。
(3)X的转化率是_____________________________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
(2)下图中表示NO2变化曲线的是________,用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭系统中有反应C(s)+CO2(g)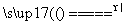 2CO(g),能使反应速度加快的措施是( )
2CO(g),能使反应速度加快的措施是( )
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2
A.①②③⑥ B.①②④⑥
C.①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:

CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是( )

A.N2(g)+3H2(g)===2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)===2NH3(g)
ΔH=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)===NH3(l)
H2(g)===NH3(l)
ΔH=(b+c-a)kJ·mol-1
D. N2(g)+
N2(g)+ H2(g)===NH3(g)
H2(g)===NH3(g)
ΔH=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,
CaC2+CO↑,
CaC2+N2 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN ,与CN
,与CN 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 ( )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示, CaO晶体中Ca2+的配位数为 ,
CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com