
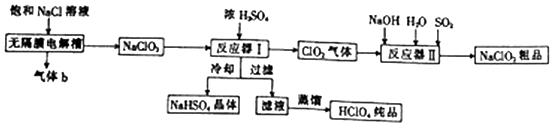
分析 由流程图可知,电解饱和氯化钠反应得到NaClO3,阳极反应式为:Cl--6e-+3H2O=ClO3-+6H+,阴极反应式为:2H++2e-=H2,气体b为还原产物H2,反应器I为NaClO3与浓硫酸反应,反应方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O,冷却反应液得到NaHSO4晶体,对滤液蒸馏得到HClO4纯品,ClO2气体在反应器Ⅱ中与氢氧化钠、水、二氧化硫生成NaClO2粗品,据此分析解答.
解答 解:(1)NaClO2中钠元素+1价,氧元素-2价,化合物中化合价代数和为0,则氯元素化合价为+3价;除去某饱和NaCl溶液中含有的CaCl2、MgCl2、Na2SO4等杂质,加氯化钡除去Na2SO4,加NaOH除去MgCl2,加碳酸钠除去CaCl2,且碳酸钠可除去过量的BaCl2,过滤后加盐酸、蒸发得到NaCl;
故答案为:+3;③②①⑤④;
(2)由流程图可知,电解饱和氯化钠反应得到NaClO3,阳极反应式为:Cl--6e-+3H2O=ClO3-+6H+,阴极反应式为:2H++2e-=H2,气体b为还原产物H2;
故答案为:H2;Cl--6e-+3H2O=ClO3-+6H+;
(3)反应器I为NaClO3与浓硫酸反应,反应方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;由题可知NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出,故冷却降低NaHSO4的溶解度,使NaHSO4结晶析出;
故答案为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;降低NaHSO4的溶解度,使NaHSO4结晶析出;
(4)ClO2气体在反应器Ⅱ中与氢氧化钠、水、二氧化硫生成NaClO2粗品,氯元素化合价降低,则硫元素化合价升高到硫酸根离子,故离子方程式为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器 II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则c(H+)=10-13,c(OH-)=10-1,则溶液中$\frac{c(O{H}^{-})•c(Cl{O}_{2}^{-})}{c(HCl{O}_{2})}$=$\frac{c(O{H}^{-})•c(Cl{{O}_{2}}^{-})•c({H}^{+})}{c(HCl{O}_{2})•c({H}^{+})}$=$\frac{{K}_{a}•c(O{H}^{-})}{c({H}^{+})}$=$\frac{1.07×1{0}^{-2}×1{0}^{-1}}{1{0}^{-13}}$=1.07×1010;
故答案为:1.07×1010.
点评 本题考查物质制备实验方案,明确化学工艺流程是解题关键,涉及电解原理、氧化还原反应方程式的书写、计算等内容,侧重于学生的分析能力、实验能力和计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1:10 | B. | 1:20 | C. | 5:1 | D. | 10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③④⑤ | C. | ①②③④⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中氧化剂与还原剂的物质的量之比为5:1 | |
| B. | 反应②中FeCl3只作氧化剂,反应③中FeCl3只是氧化产物 | |
| C. | 反应②中每生成127g I2,转移的电子数为2NA | |
| D. | 根据上述三个反应可知氧化性:ClO3->Cl2>Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32P和31P属于同一种核素 | B. | 32P的原子中所含的质子数为16 | ||
| C. | 31P的中子数为16 | D. | 32P的摩尔质量为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n可表示麦芽糖或淀粉 | |
| B. | 反应②的产物除了乙醇还有一种直线型分子 | |
| C. | 反应①③属于加成反应且所用的催化剂相同 | |
| D. | 乙酸乙酯的同分异构体(不含本身)中能与NaOH溶液反应的有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
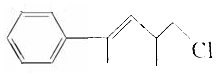 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )| A. | 分子式是C12H15Cl,属于卤代烃 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 既能使溴水褪色,又能使KMnO4 酸性溶液褪色 | |
| D. | 该溶液与酸化的AgNO3 溶液混合时会产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com