
【题目】G是某抗炎症药物的中间体,其合成路线如下:
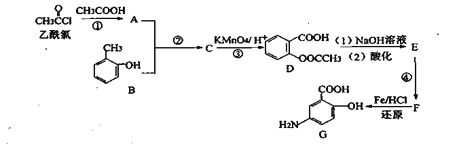
已知:①![]()
![]()
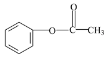
② ![]()
![]()
![]() (呈碱性,易氧化)
(呈碱性,易氧化)
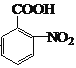
(1)C的官能团名称是_______________;
(2)反应①的反应类型为___________;反应②的作用是___________________;
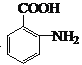
(3)下列对有机物G的性质推测不正确的是____________________ (填选项字母);
A.1molG与足量NaHCO3溶液反应放出2molCO2
B.能发生取代反应和氧化反应
C.能加聚合成高分子化合物
D.具有两性,既能与酸反应也能与碱反应
(4)写出E→F的化学反应方程式______________________________;
(5)同时符合下列条件的D的同分异构体有__________种:
①含有苯环且能发生水解反应:②能发生银镜反应;③能与NaHCO3溶液反应放出CO2。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位:苯环上有发基时,新引入的取代基连在苯环的问位。根据题中的信息,写出以甲苯为原料合成有机物的流程图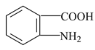 (无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X
(无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X![]() Y
Y![]() Z……目标产物
Z……目标产物
【答案】酯基 取代反应 保护酚羟基,以防被氧化 AC ![]() +HNO3
+HNO3![]()
![]() +H2O 17
+H2O 17 ![]()
![]()
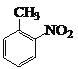
![]()
![]()
【解析】
乙酰氯和乙酸反应生成A,A和B反应生成C,C被酸性高锰酸钾溶液氧化生成D,根据D结构简式知,C为![]() ,A为(CH3CO)2O,D发生水解反应然后酸化得到E,E为
,A为(CH3CO)2O,D发生水解反应然后酸化得到E,E为![]() ,E反应生成F,F发生还原反应生成G,根据G结构简式结合题给信息知,F为
,E反应生成F,F发生还原反应生成G,根据G结构简式结合题给信息知,F为![]() ;
;
(6)甲苯和浓硝酸发生取代反应生成邻硝基甲苯,邻硝基甲苯被酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸被还原生成邻氨基苯甲酸,据此分析解答。
(1)根据分析,C为![]() ,则C的官能团名称是酯基;
,则C的官能团名称是酯基;
(2)反应①为乙酰氯和乙酸反应生成A,A为(CH3CO)2O,乙酰氯中的氯原子被取代,则反应类型为取代反应;反应②的作用是保护酚羟基,防止被氧化;
(3) A.G中只有羧基能和碳酸氢钠反应生成二氧化碳,所以1molG与足量NaHCO3溶液反应放出1molCO2,故A错误;
B.G中含有酚羟基,能发生氧化反应,不能发生消去反应,羧基能发生取代反应,故B正确;
C.G中含有羧基和酚羟基,所以能发生缩聚反应生成高分子化合物,故C错误;
D.G中含有羧基和氨基,所以具有酸性和碱性,则具有两性,既能与酸反应也能和碱反应,故D正确;
答案选AC;
(4) E为![]() ,F为
,F为![]() ,E在浓硫酸加热条件下与硝酸反应取代反应,化学反应方程式
,E在浓硫酸加热条件下与硝酸反应取代反应,化学反应方程式![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
(5)①含有苯环且能发生水解反应,说明结构中含有苯环和酯基,②能发生银镜反应,说明结构中含有醛基,③能与NaHCO3溶液反应放出CO2,说明结构中含有羧基,由以上综合分析,该有机物的结构可以由![]() 与-CH2OOCH构成,共有邻间对3种结构,或由
与-CH2OOCH构成,共有邻间对3种结构,或由![]() 与-CH3、-OOCH构成,共有10种结构,或由
与-CH3、-OOCH构成,共有10种结构,或由![]() 和-OOCH构成有邻间对3中结构,或
和-OOCH构成有邻间对3中结构,或![]() 和
和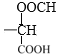 构成,只有一种结构,则同时符合下列条件的D的同分异构体有17种;
构成,只有一种结构,则同时符合下列条件的D的同分异构体有17种;
(6)甲苯和浓硝酸发生取代反应生成邻硝基甲苯,邻硝基甲苯被酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸被还原生成邻氨基苯甲酸,其合成流程图为: ![]()
![]()

![]()

![]()
 。
。


科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①石墨 ②烧碱 ③石灰水 ④氯化钠晶体 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液上述物质中能导电的是______,属于电解质的是_______,属于非电解质的是________。(填编号)
(2)按要求写出下列方程式:
①小苏打治疗胃酸过多的离子方程式:____________________。
②向氢氧化钠溶液中加入的铝片离子方程式:__________________。
(3)按要求进行化学计算:
①0.5mol某固体A的质量是40 g,A的相对分子质量为__________________。
②在同温同压同体积的条件下,H2与气体A的质量之比是1∶8,则A的摩尔质量为_____________。
③2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O,该反应氧化剂与还原剂的物质的量之比为________。
④98%的浓H2SO4(ρ=1.84 g/cm3)物质的量浓度为__________。
⑤相同物质的量浓度的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,当生成的AgCl质量相同时,消耗的三种溶液的体积比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。下列说法不正确的是

A.该分解过程是:2NO![]() N2+O2
N2+O2
B.实验室制取NO可以用铜与稀硝酸反应
C.过程②释放能量,过程③吸收能量
D.标准状况下,NO分解生成5.6 LN2转移电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量NOx和SO2,可经处理消除。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g) 4NO(g)+CO2(g)+ 2H2O(g); H1=574.0 kJ ·mol-1
CH4(g)+4NO(g) 2N2(g)+ CO2(g)+ 2H2O(g); H2= 1160.0 kJ·mol-1
①反应CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g); H3=_____;
②若该反应中将NOx还原为N2,消耗标准状况下5.6L CH4,则反应过程中转移的电子物质的量为___;
(2)用CH4原NO2的反应为CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向两个容积均为2L温度分别为T1°C、T2°C的恒温恒容密闭容器中分别加入物质的量为1 mol的CH4和2molNO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1_______T2(填“>”或“<”);
②T1°C时,40~80 min,用N2的浓度变化表示的平均反应速率为v(N2)=_____,此温度下的化学平衡常数K=______;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_____移动(填“正向”、 “逆向”或“不”);
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)碱性混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式:__________________________;
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是____________________________ ( 答出一点即可);

(4)用碱液脱硝是目前研究的课题之一。
①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液。请写出该反应的离子方程式______________________________。
②将工业上氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到下图所示的电解槽中进行电解。写出A室NO2发生的电极反应:____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如图,其总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是

A. 电极A是负极,发生氧化反应
B. 电池工作时,电解液中的H+通过质子交换膜向B电极迁移
C. 放电前后电解质溶液的pH不变
D. b物质在电极上发生的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
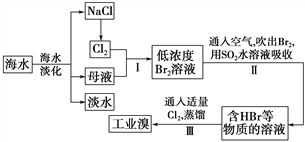
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
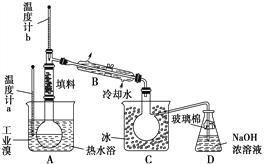
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
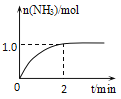
(1)0~2min内的平均反应速率v(H2)=___。
(2)该温度下,反应的平衡常数表达式K=___。
其平衡常数K与温度T的关系如下表:
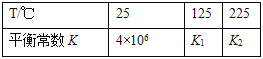
试判断K1___K2(填写“>”、“=”或“<”)。
(3)能说明该合成氨反应已达到平衡状态的是___(选填编号)。
a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
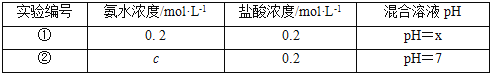
请回答:
(4)①中所得混合溶液,pH___7(填“>”、“<”或“=”);②中c__0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为___。
(5)请你设计一个能证明一水合氨是弱电解质的简要方案___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com