
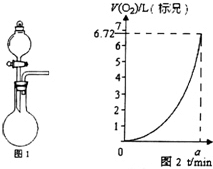
 某同学探究KMnO4溶液和H2O2的反应.
某同学探究KMnO4溶液和H2O2的反应.分析 (1)Mn元素的化合价由+7价降低为+4价,O元素的化合价由-1价升高为0;
(2)结合元素的化合价变化及氧化剂的氧化性大于氧化产物的氧化性分析;
(3)分液漏斗可控制液体的流速;
(4)结合v=$\frac{△n}{△t}$计算,由图可知氧气的物质的量增大,曲线斜率增大,则反应速率加快.
解答 解:(1)Mn元素的化合价由+7价降低为+4价,O元素的化合价由-1价升高为0,由电子、电荷及原子守恒可知,离子反应为2MnO4-+3H2O2=2MnO2+3O2↑+2H2O+2OH-,
故答案为:2;3;2;3;2;2;
(2)a.H2O2作为还原剂,被氧化,氧化产物为O2,故错误;
b.由氧化剂的氧化性大于氧化产物的氧化性可知氧化性:MnO4->O2,故正确;
c.每生成lmolO2转移2mol电子,故错误;
d.该反应中O元素的化合价升高,只体现H2O2有还原性,故错误;
故答案为:b;
(3)为实现反应可控,应将H2O2放入中分液漏斗中,故答案为:分液漏斗;
(4)由图可知,amin生成氧气为$\frac{6.72L}{22.4L/mol}$=0.3mol,v=$\frac{△n}{△t}$=$\frac{0.3}{a}$mol/min,由图可知氧气的物质的量增大,曲线斜率增大,则反应速率加快,则曲线所表示的含义为:随着反应的进行,生成O2的速率逐渐加快,可知①该反应为放热反应,产生的热量使温度升高,加快反应速率,②反应生成的MnO2起催化作用,
故答案为:$\frac{0.3}{a}$;逐渐加快;该反应为放热反应,产生的热量使温度升高,加快反应速率;反应生成的MnO2起催化作用.
点评 本题考查氧化还原反应及反应速率,为高频考点,把握反应中元素化合价变化及图象分析为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入过量CO2气体:2OH-+CO2═CO32-+H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | 2 mol•L-1的NaAlO2溶液和5 mol•L-1的盐酸溶液等体积混合均匀:2AlO2-+5H+═A1(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| B. | 氯化钠溶液在电流作用下完全电离成钠离子和氯离子 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| D. | 弱电解质的电离平衡常数与浓度、温度等条件有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
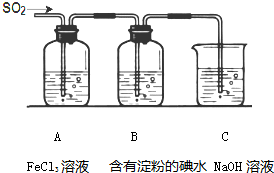 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 硫酸氢钠属于盐类,其水溶液显中性 | |
| D. | 碳酸氢钠可以用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com