
 构,层内为平面正六边形结构(如图a),试回答下列问题:图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个,碳原子数目与碳碳化学键数目之比为_______。
构,层内为平面正六边形结构(如图a),试回答下列问题:图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个,碳原子数目与碳碳化学键数目之比为_______。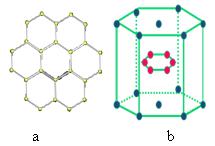
 b所示的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为______
b所示的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为______ _。
_。科目:高中化学 来源:不详 题型:单选题
| A.全对 | B.除⑤外 | C.除①④⑤⑥外 | D.除⑥⑦⑧外 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

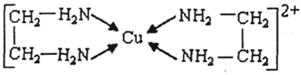
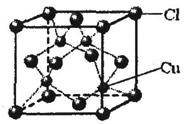
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
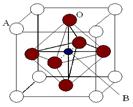

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
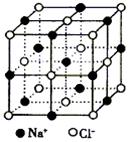
| A.M/a3ρ | B.M/2a3ρ | C.2M/a3ρ | D.2Ma3ρ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.存在四面体结构单元,O处于中心,Si处于4个顶角 |
| B.最小的环上,有3个Si原子和3个O原子 |
| C.最小的环上,Si和O原子数之比为1:2 |
| D.最小的环上,有6个Si原子和6个O原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com