
【题目】在任何条件下,纯水显中性,这是因为 ( )
A、PH=7 B、c(H+)=c(OH-)
C、c(H+)=c(OH-)=10-7mol/L D、c(H+)×c(OH-)=10-14
科目:高中化学 来源: 题型:
【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应合成:
C6H6+HNO3![]() C6H5—NO2+H2O ΔH<0
C6H5—NO2+H2O ΔH<0
已知:
①该反应在温度稍高的情况下会生成间二硝基苯。
②制备反应装置:

③有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 211 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)合成硝基苯的反应类型为_____________。
(2)制备时需要配制25 mL的浓硝酸和x mL(0.552 mol)浓硫酸(98%)混合液,混合酸应该盛放在_____________中(填写仪器名称),x值为_____________。
(3)反应在50℃~60℃下进行,其主要原因可能是__________________________(写两点即可),常用的方法是__________________________。
(4)反应完毕所得的硝基苯中混有无机物杂质,需将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液,第二次用水洗的目的是__________________________。
(5)进行分液的硝基苯中含有少许水分及有机物杂质,加入无水aCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,最后进行蒸馏纯化,蒸馏纯化的实验方案为__________________________。从实验安全角度考虑,在蒸馏纯化过程中,应选用空气冷凝管,不选用通水的直形冷凝管的原因是__________________________________。
(6)若反应开始时向仪器A中加入19.5 mL苯,反应完毕提纯后得到20 g硝基苯,则实验所得到的硝基苯产率为_____________(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程如下:

(1)Na2S2O5的名称为_______________(选填“焦硫酸钠”或“焦亚硫酸钠”)。
(2)“反应I ”中应先通入的气体是_____,反应后析出的固体产物是____________。
(3)“反应II”的化学方程式为_________________________。
(4)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是______________(任答一条即可);
②若检验产品中含有杂质Na2SO3,下列试剂的使用顺序依次为_________(填编号)。
A.稀硫酸 B.澄淸石灰水 C.品红溶液 D.酸性KMnO4溶液
(5)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为____________________;
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
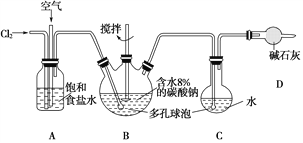
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气的体积比的方法是___________________________________。
②使用多孔球泡的作用是_____________________________________。
(2)①装置B中产生Cl2O的化学方程式为____________________________________。
②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是___________________________。
(3)装置C中采用棕色圆底烧瓶是因为________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用_________量取20.00 mL次氯酸溶液于烧杯中,_____________________________。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯硅烷(SiHCl3)在空气中极易燃烧,易与水反应生成两种酸,主要用于生产多晶硅、硅油等,熔点为134 ℃、沸点为31.8 ℃。已知氯化氢气体在加热条件下可与单质硅反应得到三氯硅烷,某同学利用如图装置制备一定量的三氯硅烷(加热装置均省略)。

(1)制备HCl气体的方法之一是将浓硫酸与浓盐酸混合,下列性质与制备原理无关的是______(填字母),B装置的作用是___________________,冰盐水的作用是________________________。
A.浓硫酸具有脱水性 B.浓硫酸具有吸水性
C.盐酸具有挥发性 D.气体的溶解度随温度升高而降低
(2)实验开始后,首先要通入一段时间的HCl气体后才能对C处试剂加热,目的是:①排出装置中空气,防止硅与氧气反应,②_____________________。该套实验装置有两处明显的错误:①E中会产生倒吸,②____________________。E装置的用途是_______________________。
(3)加热条件下,C中发生的是置换反应,相应的化学方程式为________________________。
(4)制得的SiHCl3中含有少量SiCl4(沸点为57.6 ℃),提纯SiHCl3采用的适宜方法为__________,收集SiHCl3时温度应控制在_____________。
(5)设计一个实验证明C中产生的气体是H2:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电负性是元素原子的重要性质,研究电负性的大小及其变化规律具有重要的价值。下列几种叙述中不属于电负性的应用的是( )
A. 判断一种元素是金属还是非金属
B. 判断化合物中元素化合价的正负
C. 判断化学键的类型
D. 判断化合物的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )

A. 曲线a表示Na+的物质的量的变化
B. 曲线c表示Ba2+的物质的量的变化
C. 加入50 mL Ba(OH)2溶液时反应的离子方程式为Ba2++2OH-+2H++ ![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 加入Ba(OH)2溶液体积大于50 mL后,反应的离子方程式为OH-+H+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com