
【题目】用NaOH固体配制100 mL 0.1 mol/L NaOH溶液,下列说法不正确的是
A. 须选用100 mL容量瓶 B. 须用玻璃棒搅拌或引流
C. 容量瓶使用前须查验是否漏水 D. 将配好的溶液倒入废液缸
科目:高中化学 来源: 题型:
【题目】如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示。计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀。下列说法正确的是 ( )
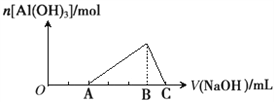
A. 原混合溶液中c(Fe3+):c(Al3+)=1:1
B. Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去
C. B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104
D. C点溶液中的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
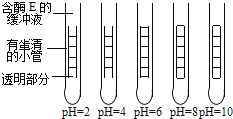
【题目】E为一种人体消化道中的酶,下图为用鸡蛋清做底物研究酶E的实验.在5支试管内分别放入含等量酶E的不同pH值缓冲液.将试管放在37℃的水浴中.然后把鸡蛋清放在同样的细玻璃管中,再把玻璃管投入沸水,使鸡蛋清经酶E的作用变得不透明.实验从将装有固化鸡蛋清的细玻璃管放入试管中开始计时.鸡蛋清经酶E的作用被消化,细玻璃管两端变得透明.
实验开始时的时间(分钟) | 鸡蛋清被消化的百分量 | ||||
pH=2 | pH=4 | pH=6 | pH=8 | pH=10 | |
0 | 0 | 0 | 0 | 0 | 0 |
4 | 28 | 12 | 0 | 0 | 0 |
8 | 55 | 29 | 3 | 0 | 0 |
12 | 94 | 53 | 10 | 3 | 0 |
每4分钟测量细玻璃管的透明部分的长度一次,计算已被消化的蛋清的百分率,所得结果见右上表.请回答:
(1)该实验的目的是 .
(2)为何用37℃水浴加热? .
(3)根据实验,你对酶E得出哪些结论? .
(4)将含酶E的缓冲液的pH值由10慢慢地调整到2,此过程中蛋清被消化的速度将 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途的叙述中,二者不具有对应关系的是
A. NH3易溶于水,可用作制冷剂
B. SO2具有漂白性,可用来漂白纸浆
C. 浓硫酸具有吸水性,可用作干燥剂
D. 漂白粉具有氧化性,可用作环境消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下H2S、H2CO3 的电离常数如下表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
② 常温下,硫化钠水解的离子方程式_____________________________。
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子。
①常温下,NaHS溶液显______(选填“酸性”、“中性”或“碱性”)
②常温下,向100 mL 0.1 mol·L-1 H2S溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
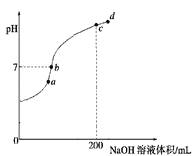
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)_______________;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定分散系中可以大量共存的粒子组是:
A.在空气中:H2 、NH3、NO 、CO2
B.在K2CO3溶液中:Na+、H+、Cl-、Br-
C.在无水乙醇的CCl4溶液中:Br2、I2、苯、甲醇
D.在Fe(NO3)3溶液中:H+、SO42-、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定为3L的某密闭容器中加入1mol A、2mol B,一定温度下发生如下发应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
A. 5 min 内D的平均反应速率为0.02 mol·L-1·min-1
B. 第5min时C的反应速率为0.06 mol·L-1·min-1
C. 经5min后,向容器内再加入A,正反应速率变大
D. 平衡状态时,生成1molD时同时生成1molA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com