
| A. | 金属性:Y>Z | B. | 氢化物的稳定性:X>W | ||
| C. | 离子的还原性:X>W | D. | 离子半径:Z>Y>X |
分析 W、X、Y、Z均为短周期元素,W的原子最外层电子数与核外电子总数之比为7:17,应为Cl元素;X与W同主族,则X为F元素;Y的原子序数是W和X的原子序数之和的一半,Y原子序数应为$\frac{17+9}{2}$=13,为Al元素;含Z元素的物质焰色反应为黄色,应为Na元素,结合元素化合物的性质以及元素周期律的递变规律解答.
解答 解:W、X、Y、Z均为短周期元素,W的原子最外层电子数与核外电子总数之比为7:17,应为Cl元素;X与W同主族,则X为F元素;Y的原子序数是W和X的原子序数之和的一半,Y原子序数应为$\frac{17+9}{2}$=13,为Al元素;含Z元素的物质焰色反应为黄色,应为Na元素.
A.同周期元素从左到右金属性逐渐减弱,则金属性Na>Al,故A错误;
B.非金属性F>Cl,非金属性越强,对应的氢化物越稳定,则稳定性HF>HCl,故B正确;
C.非金属性F>Cl,则离子还原性Cl->F-,故C错误;
D.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径F->Na+>Al3+,故D错误.
故选B.
点评 本题考查元素位置结构性质的相互关系应用,题目难度中等,注意正确推断元素的种类为解答本题的关键,注意把握元素周期律知识.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
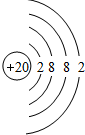 .
.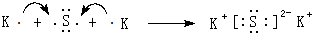 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 |
| n(HI) | 1 | 0.91 | n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ②④⑥⑧ | C. | ③⑤⑦⑧ | D. | ③④⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com