
| A. | FeO和Fe2O3的混合物 | B. | Fe2O3和Fe3O4的混合物 | ||
| C. | CuO和Fe2O3的混合物 | D. | CuO和Fe3O4的混合物 |
分析 用足量CO还原14g 金属氧化物的混合物,将生成的CO2通入足量的澄清石灰水,发生的反应方程式为FexOy+yCO$\frac{\underline{\;\;△\;\;}}{\;}$xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,或CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,Ca(OH)2+CO2═CaCO3↓+H2O,采用极端假设的方法解决,可分别假设14g氧化物是某一种具体的氧化物,并利用物质间的关系式对生成的沉淀量进行计算,从而判断出氧化物的具体情况.
解答 解:若全部是FeO,则存在FeO~CO2~CaCO3的关系式,设生成的碳酸钙质量是x
FeO~CO2~CaCO3
72 100
14g x
x=$\frac{14g×100}{72}$=19.44g
若全部是Fe2O3,则存在Fe2O3~3CO2~3CaCO3的关系式,设生成的碳酸钙质量是y
Fe2O3~3CO2~3CaCO3
160 300
14g y
y=$\frac{300×14g}{160}$=26.25g
若全部是Fe3O4,则存在Fe3O4~4CO2~4CaCO3的关系式,设生成的碳酸钙质量是z
Fe3O4~4CO2~4CaCO3
232 400
14g z
z=$\frac{40g×14g}{232}$=24.14g;
若为CuO,则则存在CuO~CO2~CaCO3的关系式,设生成的碳酸钙质量是w,
则有CuO~CO2~CaCO3
80 100
14g wg
w=$\frac{14g×100}{80}$=17.5g
因为得到CaCO3沉淀25g,所以必须是混合物,而且必须要有Fe2O3.
故选D.
点评 本题考查了混合物的计算,题目难度不大,注意利用极端假设的方法解决,把握物质之间的反应以及各物质之间的关系是解题的关键,侧重于考查学生的分析能力和计算能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl三种溶液的物质的量浓度关系为c(NH4HSO4)>c(NH4HCO3)>c(NH4Cl) | |
| B. | 将10mL0.1mol•L-1Na2CO3溶液逐滴滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | 室温下,向100mL0.1mol/LNaOH溶液中滴加0.1mol/LNH4HSO4溶液至溶液呈中性,溶液中各离子浓度大小关系:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1的某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)═2c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{16(b+a)}{b-a}$ | B. | $\frac{16(b-a)}{b+a}$ | C. | $\frac{8(b+a)}{b-a}$ | D. | $\frac{8(b-a)}{b+a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24% | B. | 30% | C. | 40% | D. | 19% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
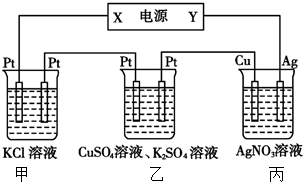
| A. | 当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g | |
| B. | 电解过程中装置丙的pH无变化 | |
| C. | 向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、Na、S、Cl、N | B. | H、Na、S、Br、P | C. | H、Li、O、F、N | D. | H、Mg、S、O、N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com