
分析 (1)化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值;
(2)根据方程式的书写反写,平衡常数是原来的倒数;
(3)根据化学平衡常数K的数值越大,化学反应进行的程度越大;
(4)根据以上有关数据,可据盖斯定律分析,NO与CO反应的K值大小,进而解答.
解答 解:(1)常温下,NO分解产生O2的反应的平衡常数表达式式K1=$\frac{c({N}_{2})•c({O}_{2})}{{c}^{2}(NO)}$,故答案为:K1=$\frac{c({N}_{2})•c({O}_{2})}{{c}^{2}(NO)}$;
(2)2H2(g)+O2(g)?2H2O(g) K2=2×1081,所以2H2O(g)?2H2(g)+O2(g) K3=$\frac{1}{2×1{0}^{81}}$=5×10-82,故答案为:5×10-82;
(3)常温下,NO、H2O、CO2三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>H2O>CO2,故答案为:NO>H2O>CO2;
(4)①N2(g)+O2(g)?2NO(g)K1=1×10-30
②2CO2(g)?2CO(g)+O2(g)K3=4×10-92
据盖斯定律①+②得N2+2CO2=2CO+2NO K=K1×K3=4×10-122,其逆反应为2CO+2NO=2CO2+N2 K=2.5×10121,K值越大,反应进行的越完全,从理论上来说,CO与NO能反应完全,
故答案为:能;反应2CO+2NO=2CO2+N2的K=1/K1K2=2.5×10121,K数值很大,反应进行完全,若使用合适催化剂加快反应速率,可以除去污染气体.
点评 本题考查的是化学平衡常数的相关知识,化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

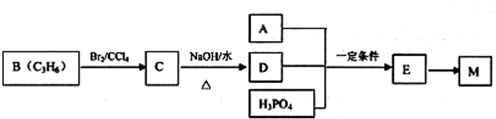
 、C
、C .反应④所用试剂和条件是氢氧化钠醇溶液、加热.
.反应④所用试剂和条件是氢氧化钠醇溶液、加热. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
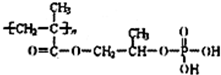
 ,该反应类型是酯化反应.
,该反应类型是酯化反应.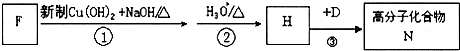
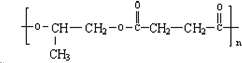
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
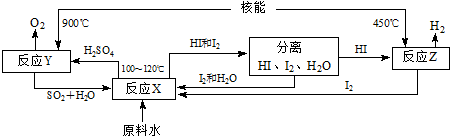
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBrO3 | B. | XeF2 | C. | HBrO4 | D. | Xe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
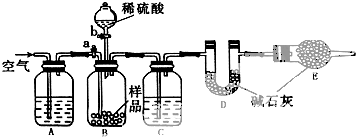
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com