
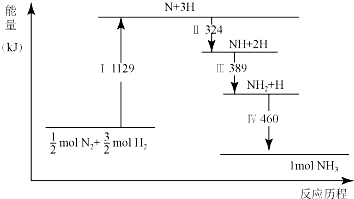
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅳ中NH2与H2生成NH3 | ||
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | D. | N2(g)+3H2(g)?2NH3(g)△H>0 |
分析 A.I 中破坏的是非极性键;
B.Ⅵ中是 NH2和H 生成 NH3;
C.中三个过程均是能量降低,所以是放热过程;
D.由图可知反应物的能量高于生成物的能量,是放热反应,因此△H<0.
解答 解:A.I 中破坏的N2和H2中的共价键是非极性键,故A错误;
B.图象中Ⅵ的变化是 NH2和H 生成 NH3,不是NH2和H2生的反应,故B错误;
C.图象中Ⅱ、Ⅲ、Ⅳ三个过程均是能量降低的变化,所以是放热过程,故C正确;
D.由图可知最终反应物的能量高于生成物的能量,是放热反应,因此△H<0,N2(g)+3H2(g)?2NH3(g)△H<0,故D错误;
故选C.
点评 本题考查了化学反应能量变化,图象分析判断,注意拆化学键吸收能量,形成化学键放出能量,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2vB正=3vA正 | |
| B. | 3vC正=2vB逆 | |
| C. | 容器中气体的平均相对分子质量不再改变 | |
| D. | 反应容器中压强不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、乙醇、乙酸 | D. | 苯酚、溴苯、苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
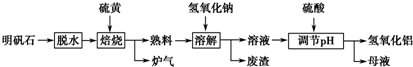
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
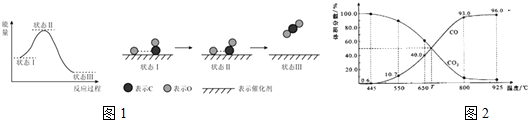
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 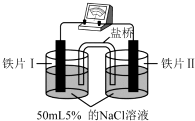 | 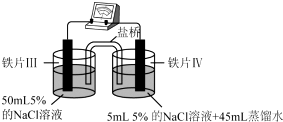 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 用K3[Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 | |
| C. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等 | |
| D. | 铁片Ⅳ的电极反应式为Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴能发生取代反应,因此不能用苯萃取溴水中的溴 | |
| B. | 相同质量的苯和立方烷(C${\;}_{{8}_{\;}}$H8)完全燃烧,耗氧量一样多 | |
| C. | 乙烯和聚乙烯都能发生加成反应 | |
| D. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
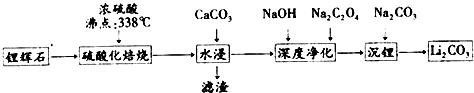
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 石油分馏和裂化的目的都是为了将长链烃转化为短链烃 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,导致蛋白质变性,失去生理活性 | |
| D. | 高分子化合物(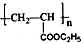 )的单体是CH2=CH2和C2H5COOH )的单体是CH2=CH2和C2H5COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com