
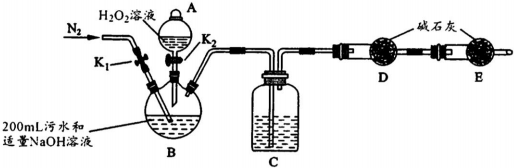
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
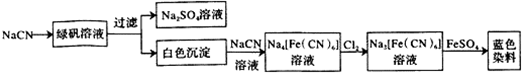
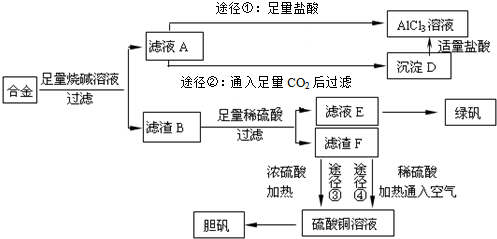
分析 (1)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水;
(2)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,据此答题;
(3)以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原 Na[Au(CN)2]生成金,根据元素的化合价的变化可知,NaCN中各元素的化合价没有变,是空气中的氧气氧化了金;
(4)本实验是利用在碱性条件下双氧水将CN-氧化成碳酸根离子,再用稀硫酸与碳酸根反应生成二氧化碳,用碱石灰吸收生成的二氧化碳,根据装有碱石灰的干燥管的质量的变化确定二氧化碳的质量,根据碳元素守恒可计算出的物质的量,进而确定浓度,在实验过程中为准确测量二氧化碳的质量,要排除空气中的二氧化碳的干扰,以及要把装置产生的二氧化碳让碱石灰充分吸收,所以要在装置里通入氮气,
①由于该实验是有气体参与反应的,所以实验开始前要检查装置气密性;从B装置三颈瓶中出来的气体中有水蒸气,能被碱石灰吸收,会对实验结果产生影响,所以气体要干燥;
②在加过双氧后,要关闭K2,再向B中加足量的稀硫酸,与碳酸根离子反应;
③为了使二氧化碳能充分被碱石灰吸收,加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量);
(5)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,据此答题;
解答 解:(1)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,反应的化学方程式为:Na2CO3+C+2NH3=2NaCN+3H2O,
故答案为:Na2CO3+C+2NH3=2NaCN+3H2O;
(2)据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-,Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,
故答案为:2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-;Fe3[Fe(CN)6]2;
(3)根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2 O+O2=4Na[Au(CN)2]+4NaOH,所以氧化剂是氧气,故答案为:O2;
(4)①由于该实验是有气体参与反应的,所以实验开始前要检查装置气密性,从B装置三颈瓶中出来的气体中有水蒸气,能被碱石灰吸收,会对实验结果产生影响,所以气体要干燥,所以C中试剂是浓H2S04,
故答案为:检查装置气密性;三颈瓶;浓H2S04;
②在加过双氧后,要关闭K2,再向B中加足量的稀硫酸,与碳酸根离子反应,
故答案为:关闭K2;稀H2S04;
③为了使二氧化碳能充分被碱石灰吸收,加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量),
故答案为:加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量);
(5)根据Kh=$\frac{c(HCN)c(O{H}^{-})}{c(C{N}^{-})}$可知,Kh=$\frac{c(HCN)c(O{H}^{-})}{c(C{N}^{-})}$=$\frac{c(HCN)c(O{H}^{-})}{c(C{N}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性,
故答案为:碱;Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性;
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,注意运用电子守恒进行计算,难度中等.


科目:高中化学 来源: 题型:实验题
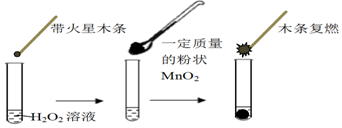
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
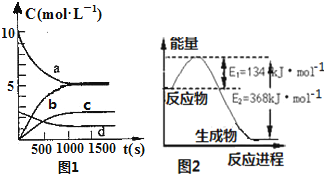 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
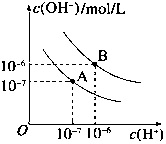 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2C1- | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com