
下列事实不能作为判断非金属性强弱依据的是
A. 单质的熔点、沸点高低
B. 非金属之间发生的置换反应
C. 非金属与氢气生成气态氢化物的难易程度
D. 非金属元素的最高价氧化物对应的水化物的酸性强弱
科目:高中化学 来源:2015-2016学年宁夏高二下期末化学试卷(解析版) 题型:选择题
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是
A.C3N4晶体是分子晶体
B.C 原子sp3杂化,与4个处于4面体顶点的N 原子形成共价键
C.C3N4晶体中C、N原子个数之比为4∶3
D.C3N4晶体中粒子间通过离子键结合
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路一中高一下期末文科化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.海洋约占地球表面积的71%,所以地球上不缺水
B.海水淡化蒸馏法的成本最 低
低
C.海水淡化的主要方法有蒸馏法、电渗析法和离子交换法等
D.以上说法都正确
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
关于证明海带中存在碘元素的实验,以下操作正确的是
A.海带中的碘可以直接用四氯化碳萃取
B.在蒸发皿中灼烧海带使之变为海带灰
C.将海带灰溶于水中,滴加淀粉溶液,溶液变蓝
D.为了将I—氧化,加入的氧化剂最好选择H2O2溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.υ(W)=3υ(Z)
B. 3υ(X)=2υ(Z)
C.υ(X)= 2υ(Y)
D. 3υ(W)=2υ(X)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
下列有关热化学方程式及其叙述正确的是
A.已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
B.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
C.已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定
D.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g)ΔH=+285.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省实验等三校高二下期末联考化学试卷(解析版) 题型:实验题
甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸(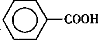 )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
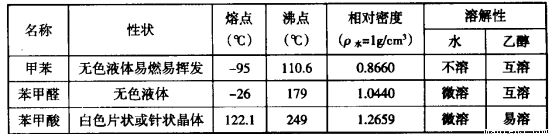
注:甲苯、苯甲醛、苯甲酸三者互溶。
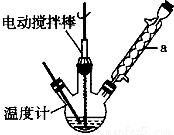
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
(1)装置a的名称是__________________,主要作用是______________________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________,此反应的原子 利用率理论上可达___________。【原子利用率=(期望产物的总质量/全部反应物的总质量)×100%】
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。【苯甲酸相对分子质量:122.0】
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春外国语学校高二下期末理化学卷(解析版) 题型:实验题
实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。

请回答下列问题:
(1)图甲中冷凝水从________(a或b)进,图乙中B装置的名称为________;
(2)反应中加入过量的乙醇,目的是________;
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:

则试剂a是________,分离方法I是________,试剂b是________;
A.浓HCl B.浓H2SO4 C.浓HNO3
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来.甲、乙两人蒸馏产物结果如下:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质.丙同学分析了上述实验目标产物后认为上述实验没有成功;试解答下列问题:
①甲实验失败的原因是________;
②乙实验失败的原因是________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一6月月考化学试卷(解析版) 题型:实验题
某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________;由图可知该装置有不妥之处,应如何改正? 。
(2)实验中改用60 mL0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会______________(填“相等”或 “不相等”),理由是_____________________________。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
(4)将V1ml 1.0mol/L HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)
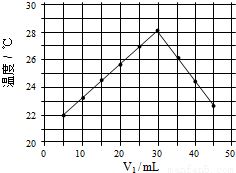
通过分析图像可知,做该实验时环境温度 (填“高于”,“低于”或“等于”)22℃,该NaOH溶液的浓度约为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com