
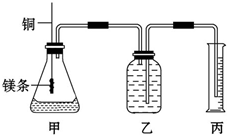
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:

科目:高中化学 来源: 题型:
| A、两个原子形成共价键时至少有1个σ键 |
| B、MgCl2分子中存在3个共价键 |
| C、N2分子中有2个σ键,1个π键 |
| D、键的强度大,含有该键的物质比较活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行) |
| B、分散系分为:溶液、胶体、浊液(标准:分散质粒子的大小) |
| C、化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化) |
| D、化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、C的体积分数 |
| C、混合气体的密度 |
| D、混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 和环状结构
和环状结构 是E的最简单的同系物.
是E的最简单的同系物.| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲组和乙组实验能观察到相同的现象 |
| B、乙组和丙组实验均能观察到蓝色沉淀 |
| C、乙组实验产生的沉淀质量比丁组多 |
| D、戊组实验产生的沉淀质量比丙组少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com