
分析 (1)取原溶液少量于试管中,向试管中不断加入氢氧化钠溶液至过量,有白色沉淀生成而后又完全消失,说明原溶液中一定含有Al3+,一定不含Mg2+;
(2)取实验①后的溶液于另一试管中,加热,用湿润的红色石蕊试纸置于试管口,结果试纸变蓝,应生成氨气,说明含有NH4+;
(3)取原溶液加入少量盐酸使溶液酸化,再加入氯化钡溶液,产生白色沉淀,说明含有SO42-;
(4)取实验③的溶液加入少量,加入硝酸银溶液,产生白色沉淀,说明生成AgCl,但不能说明原溶液含有Cl-,因实验(3)加入氯化钡.
解答 解:(1)取原溶液少量于试管中,向试管中不断加入氢氧化钠溶液至过量,有白色沉淀生成而后又完全消失,说明原溶液中一定含有Al3+,故答案为:Al3+;
(2)取实验①后的溶液于另一试管中,加热,用湿润的红色石蕊试纸置于试管口,结果试纸变蓝,应生成氨气,说明含有NH4+,故答案为:NH4+;
(3)取原溶液加入少量盐酸使溶液酸化,再加入氯化钡溶液,产生白色沉淀,说明含有SO42-,故答案为:SO42-;
(4)取实验③的溶液加入少量,加入硝酸银溶液,产生白色沉淀,说明生成AgCl,但不能说明原溶液含有Cl-,因实验(3)加入氯化钡,若要检测Cl-离子是否存在,正确的操作是取原溶液少量于试管中,用硝酸酸化,再滴加硝酸银溶液,若有白色沉淀,证明氯离子存在,否则不含氯离子,
故答案为:否;取原溶液少量于试管中,用硝酸酸化,再滴加硝酸银溶液,若有白色沉淀,证明氯离子存在,否则不含氯离子.
点评 本题考查物质的检验及鉴别,为高频考点,把握常见离子之间的反应、离子检验等为推断的关键,侧重分析与推断能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为FeSO4溶液 | |
| C. | 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
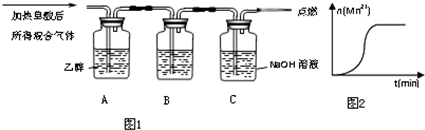
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水可区别Na2CO3和NaHCO3粉末 | |
| B. | 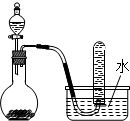 用如图装置进行浓硝酸与铜的反应制取并收集NO2 用如图装置进行浓硝酸与铜的反应制取并收集NO2 | |
| C. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 | |
| D. | 除去粗盐中的Ca2+、Mg2+、SO42-,可依次加入H2O、NaOH、BaCl2、Na2CO3,过滤再加入HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
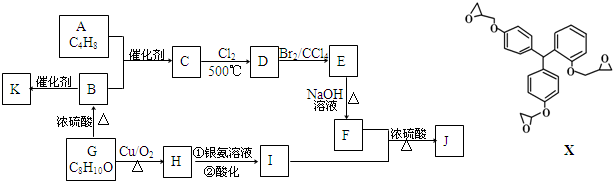
 .
.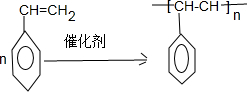 ;F+I→J
;F+I→J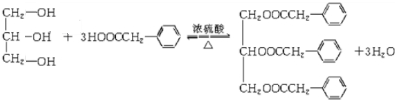 .
.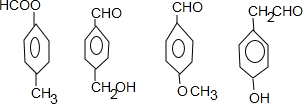 (其中三种).
(其中三种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
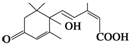 官能团的名称:碳碳双键、羰基、羟基、羧基.
官能团的名称:碳碳双键、羰基、羟基、羧基.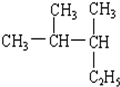 2,3-二甲基戊烷
2,3-二甲基戊烷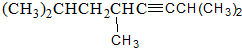 2,5,7-三甲基-3-辛炔
2,5,7-三甲基-3-辛炔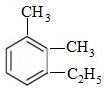
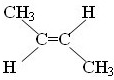 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com