
【题目】(1)已知碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11,草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1mol·L-1Na2CO3溶液的pH____0.1mol·L-1Na2C2O4溶液的pH。(填“大于”“小于”或“等于”)
②碳酸钠溶液显碱性的原因是_____________________________ 。(用主要的离子方程式表示)
③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是______(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(2)用氨水除去SO2。
已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=________mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________。
【答案】大于 CO32-+H2O![]() HCO3-+OH- ac 6.0×10-3 0.62
HCO3-+OH- ac 6.0×10-3 0.62
【解析】
(1)①根据碳酸Ka2=5.6×10-11<草酸 Ka2=6.4×10-5,酸性越弱,其强碱弱酸盐水解程度越大,碱性越强,则氢离子浓度越小,故答案为:大于;草酸;
②②碳酸钠溶液显碱性的原因是碳酸根在溶液中水解,发生反应CO32-+H2O![]() HCO3-+OH-,故答案为:CO32-+H2O
HCO3-+OH-,故答案为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
③草酸的两级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸的电离以第一步为主,因此溶液中c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-),故答案为:ac;
(2)由NH3·H2O的电离方程式及其电离平衡常数Kb=1.8×10-5可知,Kb=![]() =1.8×10-5,当氨水的浓度为2.0 mol/L时,溶液中的c(NH4+)=c(OH-)=6.0×10-3mol/L,故答案为6.0×10-3;
=1.8×10-5,当氨水的浓度为2.0 mol/L时,溶液中的c(NH4+)=c(OH-)=6.0×10-3mol/L,故答案为6.0×10-3;
由H2SO3的第二步电离方程式HSO3-SO32-+H+及其电离平衡常数Ka2=6.2×10-8可知,Ka2=![]() =6.2×10-8,将SO2通入该氨水中,当c(OH-)降至2.0×10-7mol/L时,溶液的c(H+)=1×10-7mol/L,则
=6.2×10-8,将SO2通入该氨水中,当c(OH-)降至2.0×10-7mol/L时,溶液的c(H+)=1×10-7mol/L,则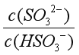 =0.62。
=0.62。


科目:高中化学 来源: 题型:
【题目】2L甲醛气体与xL的氧气混合点燃,反应后甲醛和氧气均无剩余,生成的混合气体的体积为aL(气体体积均在120°C,101kPa时测定),并将此aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL。若a-b=3.5,则x的值为
A. 2B. 4C. 1.75D. 3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
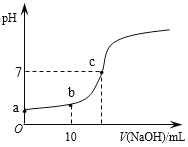
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用,苯氧布洛芬的合成路线如下:
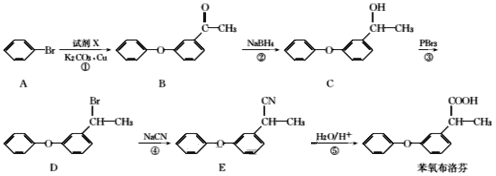
回答下列问题:
(1)苯氧布洛芬中官能团的名称为___。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A-D四种物质中,含有手性碳的有机物为___(填字母)。
(3)反应②的反应类型是___。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为___。
(5)有机物M与C互为同分异构体,M满足下列条件:
I.能与FeCl3溶液发生显色反应,1molM可消耗2molNaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3:2:2:2:2:3,且分子中含有![]() 结构。
结构。
M的结构有___种,写出其中一种结构简式:___。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2一甲基丙酸的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国黄铜矿的储量比较丰富,主要产地集中在长江中下游地区、川滇地区、山西南部、甘肃的河西走廊以及西藏高原等地。黄铜矿是一种铜铁硫化物矿物,外观黄铜色,主要成分是CuFeS2,还含有少量的SiO2和Ni、Pb、Ag、Au等元素。为实现黄铜矿的综合利用,设计了如下的工艺流程。
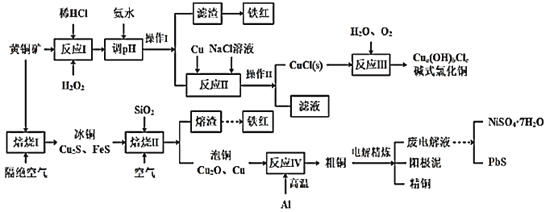
已知:①a、b、c均为整数;②CuCl+2Cl-![]() CuCl32-。
CuCl32-。
(1)CuFeS2中S的化合价为___。铁红的主要成分是___(填化学式)。
(2)实验测得“反应I”中有SO42-生成,该反应离子方程式为___,选H2O2溶液优于HNO3的原因是___。
(3)“反应II”中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(4)写出“焙烧I”发生反应的化学方程式___。
(5)废电解液中含有少量的Pb2+,从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,若废电解液的pH=4,为保证不生成NiS沉淀,Ni2+浓度应控制在___以下。(已知:饱和H2S溶液中c(H2S)为0.1mol/L,H2S的电离常数Ka1=1.0×10-7,Ka2=2.0×10-15,Ksp(NiS)=1.4×10-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.将Na2O2投入NH4Cl溶液中只可能生成一种气体
B.铁分别与稀盐酸和硫反应,产物中铁元素的化合价相同
C.向饱和ZnS溶液中加入Na2S有沉淀析出,但KSP(ZnS)不变
D.在滴有酚酞的Na2CO3溶液中,加入适量BaCl2溶液后溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g)![]() 2NO2(g)和3O2(g)
2NO2(g)和3O2(g)![]() 2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A. α1、α2均减小,c1、c2均增大
B. α1、α2均增大,c1、c2均减小
C. α1减小,α2增大,c1、c2均增大
D. α1减小,α2增大,c1增大,c2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在298K、100kPa时,
①C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1;
③2C2H2(g)+5O2(g)=4CO2(g)+ 2H2O(l) △H3=-2599kJ·mol-1;
则反应2C(s,石墨)+H2(g)=C2H2(g)的反应热△H为( )
A.-237.46kJ·mol-1B.+226.7kJ·mol-1
C.-226.7kJ·mol-1D.+237.46kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com