
| A. | AlCl3 | B. | Al(OH)3 | C. | Na2CO3 | D. | Al |
分析 根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属元素:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;b、个别酸性氧化物SiO2;c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应,以此解答本题.
解答 解:A.AlCl3能与氢氧化钠溶液反应生成氢氧化铝和氯化钠或偏氯酸钠和氯化钠和水,但不与盐酸反应,故A错误;
B.氢氧化铝是两性氢氧化物,能与盐酸反应生成氯化铝与水,与氢氧化钠反应生成偏铝酸钠与水,故B正确;
C.Na2CO3与盐酸反应生成二氧化碳、氯化钠和水,与氢氧化钠不反应,故C错误;
D.Al与盐酸反应生成氯化铝与氢气,与氢氧化钠溶液反应反应生成偏铝酸钠与氢气,但Al属于单质,不是化合物,故D错误;
故选B.
点评 本题考查了元素化合物的性质,题目难度不大,明确物质的性质是解本题的关键,注意根据中学常见的既能与酸反应又能与碱反应的物质,D为易错点,学生容易忽略“化合物”限制条件.


科目:高中化学 来源: 题型:选择题
| A. | 海水中提取镁的过程不涉及氧化还原反应 | |
| B. | 海水晒盐的过程发生复分解反应 | |
| C. | 从海水中提取铀等微量元素是海水资源综合利用研究方向之一 | |
| D. | 将明矾加入海水中静置过滤是海水淡化的方法之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构简式是CH2CH2 | |
| B. | 使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| C. | 燃烧没有甲烷剧烈 | |
| D. | 性质比较稳定,不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于冰中的水分子间存在氢键,所以其密度大于液态水 | |
| B. | 可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大 | |
| C. | 分子间氢键和分子内氢键都会使熔沸点升高 | |
| D. | 每一个水分子内平均含有两个氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
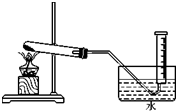 为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质C和D的浓度相等 | |
| B. | 混合气体的平均相对分子质量不再变化 | |
| C. | A的物质的量浓度不再变化 | |
| D. | 物质B,C,D的物质的量之比为2:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com