
分析 (1)由反应物、生成物及电子守恒书写化学反应;
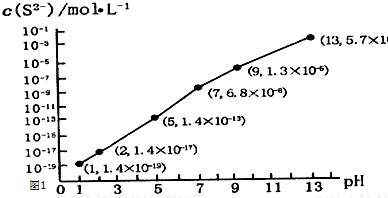
(2)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;根据MnS和FeS的Ksp计算;
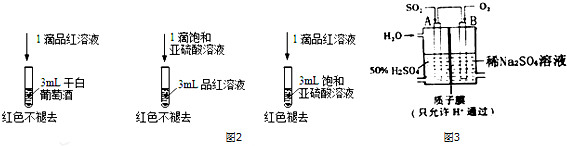
(3)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果;
(4)电池本质是二氧化硫、氧气与水反应生成硫酸,A电极为负极,B电极为正极,A电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成.
解答 解:(1)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,该反应的化学方程式为5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,则离子方程式为:5H2S+2MnO4-+6H+=5S↓+2Mn2++8H2O;
故答案为:5H2S+2MnO4-+6H+=5S↓+2Mn2++8H2O;
(2)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(FeS)时开始沉淀,所以c(S2-)=$\frac{Ksp(FeS)}{c(F{e}^{2+})}$=$\frac{1.4×1{0}^{-19}}{0.01}$mol/L=1.4×10-17mol/L,结合图象得出此时的pH=2,所以pH=2时亚铁离子开始沉淀;
溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=$\frac{Ksp(MnS)}{Ksp(FeS)}$=$\frac{2.8×1{0}^{-13}}{1.4×1{0}^{-19}}$mol/L=2×106;
故答案为:2;2×106;
(3)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果,干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少,
故答案为:干白中二氧化硫或亚硫酸含量太少;
(4)本质是二氧化硫、氧气与水反应生成硫酸,A电极为负极,B电极为正极,电子从负极流向正极,则电子流入的电极为B极,A电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,
故答案为:B;SO2+2H2O-2e -═SO42-+4H+.
点评 本题考查物质性质探究实验、原电池原理及计算等,掌握物质的性质理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 元素最高化合价的顺序为Z>Y>T>X | |
| B. | Y、Z分别形成的简单氢化物的稳定性为Z>Y | |
| C. | 由X、Y和Z三种元素构成的强电解质,对水的电离均起抑制作用 | |
| D. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数大小顺序为Z>Y>X | B. | W、X的简单离子能抑制水的电离 | ||
| C. | 单质的熔点大小顺序为X>W>Y | D. | 原子半径大小顺序为X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>X>Y | |
| B. | 最高价氧化物的水化物酸性强弱W>Z>Y | |
| C. | 简单气态氢化物的稳定性Z>W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稀释浓硫酸时把水沿着烧杯内壁缓慢注入浓硫酸中,并用玻璃棒搅拌 | |
| B. | 称量2.0gNaOH固体时先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 | |
| C. | 用装置甲除去乙烯中少量SO2气体 | |
| D. | 用装置乙分液,从分液漏斗下口放出有机相,关闭活塞再从分液漏斗上口倒出水相 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入足量浓NaOH溶液并微热,产生能使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中含NH4+ |
| C | 常温下,测得饱和NaA溶液的pH大于饱和NaB溶液 | 常温下水解程度:A->B- |
| D | 向蔗糖溶液中滴加少量稀H2SO4,水浴加热;向其中滴加少量新制Cu(OH)2悬浊液,加热,无明显现象 | 蔗糖没有水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将稀硫酸改成浓硫酸 | B. | 将纯锌换成含铜、铅等杂质的粗锌 | ||
| C. | 往稀硫酸中滴加浓度更大的硝酸 | D. | 往稀硫酸中加入K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com