
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 某温度下,如果平衡浓度符合下列关系式:![]() =
=![]() ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
【答案】C
【解析】A、依据平衡常数表达式是生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到化学方程式式为K=![]() ,化学方程式为:CO(g)+H2O(g)
,化学方程式为:CO(g)+H2O(g)![]() CO2(g)+H2(g),故A正确;B、分析图表数据,平衡常数随温度升高减小,说明升温平衡逆向进行逆向是吸热反应,正反应是放热反应,故B正确;C、依据化学平衡三段式列式计算浓度商和平衡常数比较分析,若在一定体积的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,
CO2(g)+H2(g),故A正确;B、分析图表数据,平衡常数随温度升高减小,说明升温平衡逆向进行逆向是吸热反应,正反应是放热反应,故B正确;C、依据化学平衡三段式列式计算浓度商和平衡常数比较分析,若在一定体积的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol)0 0 11
变化量(mol)0.4 0.4 0.40.4
平衡量(mol)0.40.4 0.6 0.6
反应前后气体物质的量不变,可以用其他物质的量代替平衡浓度计算,Qc=![]() =2.25≠1,此时反应没有达到平衡状态,故C错误;D、依据平衡常数表达式和平衡常数数值计算分析,温度为1000℃平衡常数K=
=2.25≠1,此时反应没有达到平衡状态,故C错误;D、依据平衡常数表达式和平衡常数数值计算分析,温度为1000℃平衡常数K=![]() =0.6=
=0.6=![]() ,若平衡浓度符合下列关系式:
,若平衡浓度符合下列关系式:![]() =
=![]() ,说明反应达到平衡状态,故D正确;故选C。
,说明反应达到平衡状态,故D正确;故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体。潮湿环境中易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂,可溶于水)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色品体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到5.64g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为__________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)步骤④中进行洗涤的操作方法为________________________________。
(6)洗涤产品时,如何证明产品已经洗涤干净?______________________。
(7)本实验中[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~③仪器的名称:

①_________;② _________;③__________ ;
仪器①~④中,使用时必须检查是否漏水的有 _______.(填仪器序号)
(2)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.

现用该浓硫酸配制480mL1molL-1的稀硫酸.请回答下列问题:
a. 该硫酸的物质的量浓度为__________molL-1
b.经计算,配制480mL1molL-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL;
c.配制过程中下列各项操作会导致所配稀硫酸浓度偏小的是_____(双选)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.所选用的烧杯、玻璃棒未洗涤
C.定容时,俯视容量瓶刻度线
D.摇匀后静置发现液面低于刻度线,继续滴加蒸馏水至刻度处.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
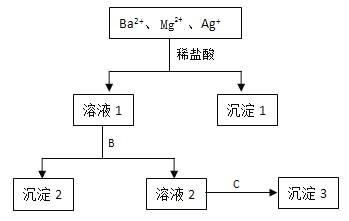
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中书写正确的是( )
A. NaHSO4![]() Na++H++SO42﹣ B. NaHCO3
Na++H++SO42﹣ B. NaHCO3![]() Na++H++CO32﹣
Na++H++CO32﹣
C. HClO=H++ClO﹣ D. MgCl2═Mg2++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( )
A.+3
B.+4
C.+5
D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )
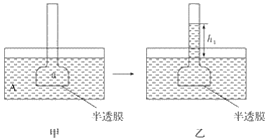
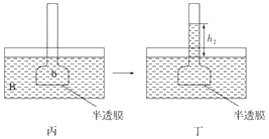
A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com