
| A、至少存在4种离子 |
| B、Clˉ一定存在,且c(Clˉ)=0.4mol?L-1 |
| C、SO42ˉ、NH4+一定存在,AlO2-可能存在 |
| D、CO32ˉ、Al3+一定不存在,K+可能存在 |
| 1.6g |
| 160g/mol |
| 4.66g |
| 233g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
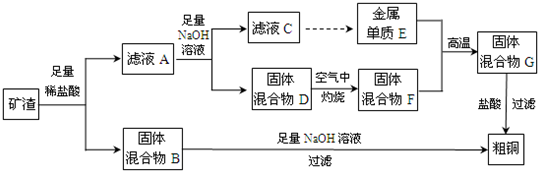
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、蒸馏、蒸发、分液、升华 |
| B、蒸馏、洗气、分液、蒸发 |
| C、蒸馏、分液、过滤、升华 |
| D、蒸发、分液、过滤、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 研究确定六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途.下列推测正确的是( )
研究确定六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途.下列推测正确的是( )| A、SF6中各原子均达到8电子稳定结构 |
| B、SF6分子中既含有非极性共价键键又含有极性共价键 |
| C、SF6分子是含有极性键的非极性分子 |
| D、SF6可能是原子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com