
| 温度/K | 973 | 1173 | 1373 | 1573 |
| K | 1.47 | 2.15 | 3.36 | 8.92 |
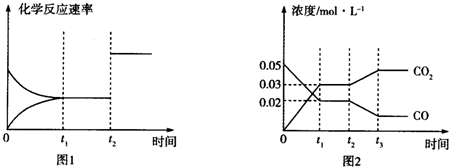
分析 (1)发生反应:Fe3O4+4CO=3Fe+4CO2,根据盖斯定律书写目标热化学方程式;
(2)①升高温度平衡向吸热反应方向,根据平衡常数变化确定反应热;
②当可逆反应达到平衡状态时,正逆反应速率相等,各物质的物质的量、物质的量浓度及由此引起的一系列物理量不变;
(3)①图2中若t1=0.5min,则0~t1时间段内,CO的平均反应速率v(CO)=$\frac{(0.05-0.02)}{0.5}$=
0.06mol/(L.min)=0.001mol•L-1•s-1 ,同一化学反应中同一段时间内各物质的反应速率之比等于其计量数之比;
②图1中t2时刻改变的条件是催化剂或压强;图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度;
(4)以CO为燃料制作燃料电池,负极上CO失去电子,电解熔融Al2O3,利用电子守恒计算.
解答 解:(1)已知:①Fe3O4(s)+4C(石墨)?3Fe(s)+4CO(g)△H=+646.0kJ/mol
②C(石墨)+CO2(g)?2CO(g)△H=+172.5kJ/mol
根据盖斯定律,①-②×4可得Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g),故△H=+646.0kJ/mol-4×(+172.5kJ/mol)=-44.0kJ/mol,故反应热化学方程式为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol,
故答案为:-44.0kJ/mol;
(2)①升高温度平衡向吸热反应方向,根据表中数据知,升高温度平衡常数增大,平衡正向移动,则正反应是吸热反应,故答案为:吸热;
②当可逆反应达到平衡状态时,正逆反应速率相等,各物质的物质的量、物质的量浓度及由此引起的一系列物理量不变,
A.c(CO2)=c(CO)时正逆反应速率不一定相等,反应不一定达到平衡平衡状态,故错误;
B.v正(CO2)=v逆(CO)=v正(CO),正逆反应速率相等,反应达到平衡状态,故正确;
C.反应前后气体计量数之和不变,所以无论是否达到平衡状态,体系压强不变,不能据此判断平衡状态,故错误;
D.混合气体中c(CO)不变,正逆反应速率不变,反应达到平衡状态,故正确;
故选BD;
(3)①图2中若t1=0.5min,则0~t1时间段内,CO的平均反应速率v(CO)=$\frac{(0.05-0.02)}{0.5}$=
0.006mol•L-1•s-1 ,同一化学反应中同一段时间内各物质的反应速率之比等于其计量数之比,所以v(H2O)=v(CO)=0.005mol•L-1•s-1,
故答案为:0.006mol•L-1•s-1;
②图1中t2时刻改变的条件时正逆反应速率都增大且正逆反应速率相等,所以改变的条件是催化剂或压强;图2中t2时刻改变的条件时,二氧化碳浓度增大、CO浓度降低,平衡逆向移动,改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度,
故答案为:加入催化剂或增大压强;降低温度或增大水蒸气浓度或减小氢气浓度;
(4)以CO为燃料制作燃料电池,负极上CO失去电子,负极反应式为CO+CO32--2e-=2CO2,电解熔融Al2O3,由电子守恒可知,4Al~12e-~3O2,理论上需要氧气的体积为$\frac{10.8g}{27g/mol}$×$\frac{3}{4}$×22.4L/mol=6.72L,
故答案为:CO+CO32--2e-=2CO2;6.72.
点评 本题考查图象分析、盖斯定律、化学平衡计算、原电池原理等知识点,侧重考查学生分析计算能力,为高频考点,会根据图中v-t图象确定改变的条件,易错点是电极反应式的书写,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数为222 | |
| B. | 中子数为86 | |
| C. | 质量数为308 | |
| D. | 与${\;}_{86}^{219}$Rn、${\;}_{86}^{220}$Rn互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成H2、O2与H2在O2中燃烧生成H2O | |
| B. | H2和I2在高温下边化合边分解 | |
| C. | 溶解与结晶 | |
| D. | SO2通入品红溶液褪色,加热后又恢复红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )
天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )| A. | 氧化剂 | B. | 还原剂 | C. | 强酸 | D. | 强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2SO3制备少量SO2:SO${\;}_{3}^{2-}$+2H+═SO2↑+H2O | |
| B. | Na2SO3溶液使酚酞试剂变红:SO${\;}_{3}^{2-}$+H2O═OH-+HSO${\;}_{3}^{-}$ | |
| C. | 用Ba(NO3)2溶液检验HSO${\;}_{3}^{-}$:HSO${\;}_{3}^{-}$+Ba2+═BaSO3↓+H+ | |
| D. | 用NaHSO3溶液检验H2S气体:2H2S+H++HSO${\;}_{3}^{-}$═3S↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com