
| A. | 氯化氢 | B. | 甲烷 | C. | 水 | D. | 硫化钠 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族(H元素除外)、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.HCl中H-Cl原子之间只存在共价键,为共价化合物,故A错误;
B.甲烷分子中C-H原子之间只存在共价键,为共价化合物,故B错误;
C.水分子中H-O原子之间只存在共价键,为共价化合物,故C错误;
D.硫化钠中钠离子和硫离子之间只存在离子键,为离子化合物,故D正确;
故选D.
点评 本题考查了离子键和共价键的判断,根据物质的构成微粒及微粒间的作用力来确定化学键,注意离子键和共价键的区别,题目难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 在镀件上镀铜时,将镀件与电源的负极相连 | |
| B. | 用电解法精炼铜时,用稀硫酸作电解质溶液 | |
| C. | 碱性电池负极由锌片改为锌粉,可大幅提高放电电流 | |
| D. | 实验室用锌与稀硫酸反应制取氢气时,向硫酸溶液中滴加几滴CuSO4溶液,可加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
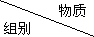 | 甲 | 乙 | 丙 |
| A | NaHCO3 | HCl | Ca(OH)2 |
| B | O2 | SO2 | NaOH |
| C | NH3 | NO2 | H2O |
| D | H2SO4(浓) | Fe | S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
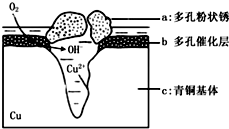 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )
如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )| A. | 腐蚀过程中,负极是 b 和 c | |
| B. | 生 成 Cu 2( OH )3 Cl 的 离子方程式为:2Cu2++3OH -═Cu 2( OH ) 3+ | |
| C. | 若生成 4.29gCu 2( OH )3 Cl,则理论上消耗标准状况氧气体积为0.448L | |
| D. | 正极的电极反应式为:O 2-4e-+2H+═2OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com