
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
分析 A.钢铁腐蚀常在中性溶液中进行;
B.碳酸钠溶液呈碱性,有利于油脂的水解;
C.明矾不具有杀菌消毒能力;
D.光导纤维为无机物.
解答 解:A.自然界中钢铁的表面易形成弱酸性或中性环境,易发生吸氧腐蚀,所以钢铁的腐蚀以吸氧腐蚀为主,故A错误;
B.碳酸钠为强碱弱酸盐,溶液呈碱性,有利于油脂的水解,故B正确;
C.明矾不具有杀菌消毒能力,只能用于净水,除去水中的悬浮物,故C错误;
D.光导纤维为无机物,不是有机高分子材料,故D错误.
故选B.
点评 本题综合考查物质的性质以及应用,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意把握常见物质的性质与用途的关系,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100mL2mol/LMgCl2溶液 | B. | 200mL2mol/LNaCl溶液 | ||
| C. | 250mL1mol/LAlCl3溶液 | D. | 100mL2mol/LKClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
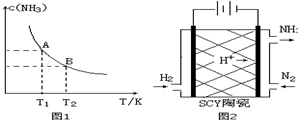
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
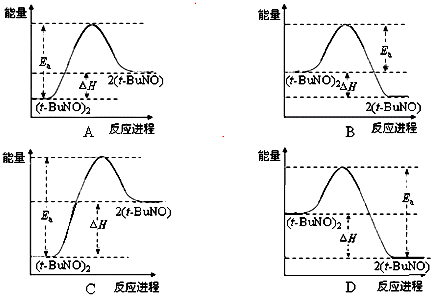
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
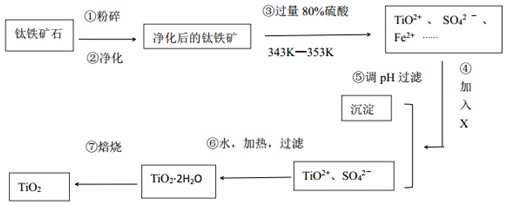
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
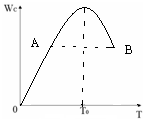 对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.21 g氯化钠 | B. | 用10 mL量筒量取7.50 mL稀硫酸 | ||
| C. | 用25 mL滴定管量取14.86 mL溶液 | D. | 用广泛pH试纸测得溶液的pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com