
【题目】NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42﹣.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是
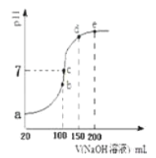
A.a点的溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(Na+)>c(OH﹣)
B.b点的溶液中:c(Na+)=c(SO42﹣)>c(H+)>c(NH4+)>c(OH﹣)
C.c点的溶液中:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
D.d、e点对应溶液中,水电离程度大小关系是d>e
【答案】B
【解析】
A.a点的溶液中,100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液为20mL,NH4HSO4过量,剩余的NH4HSO4大约是Na+的4倍,已知NH4HSO4=NH4++H++SO42-,所以c(SO42-)>c(NH4+)>c(H+)>c(Na+)>c(OH-),故A正确;
B.b点NaOH为100mL,NH4HSO4与NaOH等物质的量反应生成等浓度的(NH4)2SO4和Na2SO4,溶液显弱酸性,由于Na+、SO42-都不水解,所以c(Na+)=c(SO42-),NH4+水解显酸性,水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.c点的溶液pH=7,NaOH稍微过量,则c(Na+)>c(SO42-),溶液中c(OH-)=c(H+),所以溶液中离子浓度关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;
D.d、e点对应溶液中,氨水过量,溶液显碱性,氨水电离的氢氧根离子抑制了水的电离,氢氧根离子浓度越大,水的电离程度越小,由图可知,e点溶液中氢氧根离子浓度大,则水的电离程度小,即水电离程度大小关系是d>e,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入3 mol A和2 mol B发生如下反应:3A(g)+B(g)![]() xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积和温度不变,按起始物质的量A 0.6 mol、B 1.2 mol、C 1.6 mol充入容器达到平衡后,C的体积分数还为W%。则x的值( )
xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积和温度不变,按起始物质的量A 0.6 mol、B 1.2 mol、C 1.6 mol充入容器达到平衡后,C的体积分数还为W%。则x的值( )
A. 只能为2 B. 只能为4 C. 可能为2,可能为4 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25 mL0.1mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH与CH3COOH 溶液体积关系如图所示。下列有关粒子浓度关系正确的是

A. 曲线上A、B间的任意一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列有关说法正确的是
2SO3(g),下列有关说法正确的是
A.由图①可知:该反应的△H>0
B.在图②中的t1时充入少量氩气,容器内压强增大,平衡右移
C.图③所示条件下,平衡常数为2
D.图④中的y可以表示平衡常数或密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。
(3)“调pH”时pH的调控范围为__________________。
(4)写出“沉镍”时发生反应的离子方程式:________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________,当Ca2+沉淀完全时,溶液中c(F-)>____________mol·L-1(写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各粒子、粒子对应的立体构型及解释均正确的是( )
选项 | 粒子 | 立体构型 | 解释 |
A | 氨基负离子(NH2—) | 直线形 | N原子采用sp杂化 |
B | 二氧化硫(SO2) | V形 | S原子采用sp3杂化 |
C | 碳酸根离子(CO32—) | 三角锥形 | C原子采用sp3杂化 |
D | 碘三正离子(I3+) | V形 | I原子采用sp3杂化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
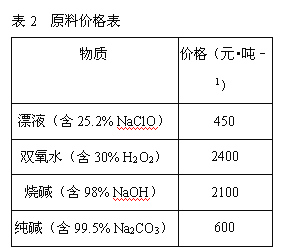
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁。
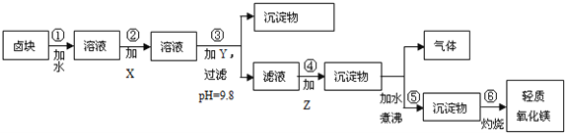
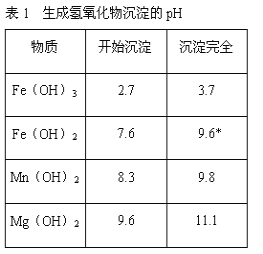
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:(注*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去)。
(1)铁元素位于 第____族____区,其中Fe2+ 核外电子排布式为____,
(2)在步骤②中加入的试剂X,最佳的选择是__________,写出步骤②中pH=1时所发生反应的离子方程式:__________;
(3)在步骤③中加入的试剂是____;之所以要控制pH=9.8,其目的是_______;
(4)已知在步骤⑤中发生的反应是____,写出步骤⑥的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+ 2KNO3+ 3C![]() 3CO2↑+ A + N2↑(已配平)
3CO2↑+ A + N2↑(已配平)
①除S外,上列元素的电负性从大到小依次为__________。
②生成物A的晶体类型为__________,含极性共价键的分子的中心原子轨道杂化类型为_______。
③已知CN-与N2结构相似,推算HCN分子中![]() 键与
键与![]() 键数目之比为____________。
键数目之比为____________。
(2)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_________。
(3)下列有关说法正确的是______________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如图

D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
(4)含有Cu2+ 的溶液中加入过量氨水,发现生成深蓝色溶液,试写出反应的离子方程式:_______。
(5)氮化硼形成立方晶体,晶体结构类似金刚石,如图所示。
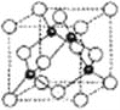
已知:该晶体密度为ρg·㎝-3,NA代表阿伏加德罗常数的值。
①该晶体的化学式为______________。
②在该晶体中,B与N形成共价键的键长(d)为________________________pm(列式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com