
����Ŀ��ClO2�ڳ�������һ�ֻ���ɫ�д̼�����ζ�����壬�۵㣺��59�棬�е㣺11.0�棬������ˮ����ҵ�����Գ�ʪ��KClO3 �� �Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ������ͼ1��ʾװ��ģ�ҵ��ȡ���ռ�ClO2 �� 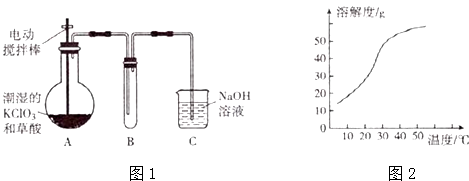
��1��Aװ�D���������¶ȿ���װ�ã����ƾ����⣬��Ҫ�IJ����������ձ���
��2��Bװ�ñ�����ڱ�ˮԡ�У���ԭ���� ��
��3����Ӧ����װ��C�пɵ�NaClO2��Һ����֪����1��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O�����¶ȸ���38��ʱ�����ľ�����NaClO2 �� ���¶��{��60��ʱNaClO2 �� �ֽ�����NaClO3��NaCl����2��NaClO2���ܽ��������ͼ2��ʾ���벹���NaClO2��Һ���Ƶ�NaClO2����IJ������裺
�ټ�ѹ��55�������ᾧ��������ϴ�ӣ������õ���Ʒ��
��4����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2 �� �÷�Ӧ�����ӷ���ʽΪ
��5������ClO2������������ˮ�Ậ��һ�������������Σ���Ҫ��ȥ������������Σ��������������˵���������ţ���
A.����
B.�⻯��
C.����
D.��������
��6������ClO2������������ķ�Ӧ�������£�
NO ![]() NO2
NO2 ![]() ����Ⱦ����
����Ⱦ����
��Ӧ��Ļ�ѧ����ʽΪ2NO+ClO2+H2O�TNO2+HNO3+HCl����Ӧ������ӷ���ʽΪ
���𰸡�
��1���¶ȼ�
��2��ʹClO2������������ٻӷ�
��3�����ȹ��ˣ�����60�����
��4��5ClO2��+4H+�TCl��+4ClO2��+2H2O
��5��D
��6��2NO2+4SO32���TN2+4SO42�� ��
���������⣺��1����Ӧװ��A�еIJ����������ƾ��ơ��ձ��⣬����Ҫ��֪��Ӧ���¶ȣ���Ҫ�¶ȼƣ����Դ��ǣ��¶ȼƣ���2���������ȵ��۵�ϵͣ�Ϊ�ռ��������ȣ�Ӧ�ڽϵ��¶��½��У�����Ӧ�ò��ñ�ˮԡ��
���Դ��ǣ�ʹClO2������������ٻӷ�����3����NaClO2��Һ���Ƶ�NaClO2����IJ������裺�ټ�ѹ��55�������ᾧ���ڳ��ȹ��ˣ�����38�桫60����ˮϴ�ӣ��ܵ���60�����õ���Ʒ��
���Դ��ǣ����ȹ��ˣ�����60������4��������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2 �� ����Ԫ���غ��֪Ӧ����ˮ���ɣ��÷�Ӧ�����ӷ���ʽΪ��4H++5ClO2��=Cl��+4ClO2��+2H2O��
���Դ��ǣ�5ClO2��+4H+�TCl��+4ClO2��+2H2O����5����Ҫ��ȥ������������Σ�AC�����ܻ�ԭ�������Σ�B��KI���л�ԭ�Ե��������ﲻ�ʺ�����ˮʹ�ã�ֻ��D��Fe2+��ClO2����ԭ��Cl�� �� Fe2+ ������Ϊ�����ӣ���������ˮ�����ɽ���ɾ�������ˮ���������˵���D��
���Դ��ǣ�D����6���������̷�Ӧ��Ϊ�����������������������������ƣ���������ԭ�ɵ��������ӷ���ʽΪ��2NO2+4SO32���TN2+4SO42�� �� ���Դ��ǣ�2NO2+4SO32���TN2+4SO42�� ��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����VL�ܱ������У�A��B��C�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ�����
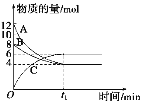
(1)��Ӧ�Ļ�ѧ����ʽΪ__________________��
(2)�ӿ�ʼ��t1 minĩʱ��������C��ʾ�ķ�Ӧ����Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�
A.�ƼغϽ��þ���Ͻ����ܶ�С��Ӳ�ȴ�ĺϽ�
B.�������Ҵ��������ʱ��Ժ����������ӵľۼ����ǻ�ѧ�仯
C.ʯ�ͻ������ѽ���������Ϊ��ˮ��ȡ�嵥�ʵ���ȡ��
D.�й��Ŵ����ü��ȵ��������̷��ķ�����ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ȷ�Ӧ�����Է���Ӧ
B.��SΪ��ֵ�ķ�Ӧ�����Է���Ӧ
C.���ʵ������ӵķ�Ӧ����SΪ��ֵ
D.�����H�͡�S��Ϊ��ֵ�����¶�����ʱ����Ӧ�����Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.ʳ����ʯӢ�ۻ�ʱ���˷��������������ͬ
B.SiHFBr2����������ԭ�ӵ�������Ϊ8���ȶ��ṹ
C.��ˮ��3.8��ʱ�ͱ�������ȱ�������������ˮ���Ӽ��������й�
D.NaHSO4�����ڻ�ʱ�ƻ��˸������е����Ӽ����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ƶ��������ʵ�������ȷ����(����)
������ɫ��������������������С���С����۵����100�桡���ܶȱ�ˮС�����Ⱥ͵��������
A.���٢ڢܢ�B.���٢ڢۢ�
C.���٢ۢܢ�D.�٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�����ӷ���ʽ�У���ȷ����
A. ����ı�ȼ����Ϊ��890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4(g)��2O2(g)===CO2(g)��2H2O(g)����H����890.3 kJ��mol��1
B. 500 �桢30 MPa�£���0.5 mol N2��1.5 mol H2�����ܱ������г�ַ�Ӧ����NH3(g)������19.3 kJ�����Ȼ�ѧ����ʽΪN2(g)��3H2(g) ![]() 2NH3(g) ��H����38.6 kJ��mol��1
2NH3(g) ��H����38.6 kJ��mol��1
C. �Ȼ�þ��Һ�백ˮ��Ӧ��Mg2����2OH��===Mg(OH)2��
D. ����������NaOH��Һ��Al2O3��2OH��===2AlO![]() ��H2O
��H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com