
| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | p | S | Cl | Ar |
| 原子结构 示意图 |  |  |  |  |  |  |  |  |
分析 (1)根据原子中核电荷数=质子数=核外电子数,进行分析解答;
(2)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切进行解答;
(3)镁元素与氯元素形成的化合物时,镁失去2个电子,显+2价,氯得1个电子,显-1价,据此书写化学式;
(4)核外电子层数相同的原子的元素位于同一周期,据此答题;
(5)根据铝原子最外层电子数为3,容易失去3个电子进行解答;
(6)硫与氧气反应生成二氧化硫,根据反应方程式可计算出生成二氧化硫的物质的量,并计算出分子数.
解答 解:(1)根据磷原子的结构示意图可知,磷原子核外有15个电子,磷原子的核电荷数也为15,
故答案为:15;
(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,当最外层电子数为8,则具有相对稳定结构,所以具有相对稳定结构的元素是氩元素,
故答案为:氩元素;
(3)镁元素与氯元素形成的化合物时,镁失去2个电子,显+2价,氯得1个电子,显-1价,所以镁与氯化合的化学式为MgCl2,
故答案为:MgCl2;
(4)由元素周期表中某一周期元素的原子结构示意图可以看出,处于同一周期的原子,核外电子层数相同,
故答案为:原子核外电子层数相同;
(5)根据铝原子最外层电子数为3,容易失去3个电子,
故答案为:3;
(6)硫与氧气反应生成二氧化硫,反应的方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,根据反应方程式可知,每个氧分子反应生成1个二氧化硫分子,设N个氧气分子的质量为32g,64g氧气应为2N,与足量硫粉完全反应生成的二氧化硫分子数为2N,
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;2.
点评 本题难度不大,考查学生对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是正确解题的关键.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙显黄色的溶液:Na+、NO3-、SO32-、Fe3+ | |
| B. | 加入Al粉能放出H2的溶液:Al3+、NO3-、HCO3-、Ba2+ | |
| C. | c(OH -)水=1×10-12的溶液:K+、NH4+、Cl -、SO42- | |
| D. | 能使pH试纸显深红色的溶液:Fe 2+、Cl -、Ba 2+、ClO - |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4 mol•L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度/mol•L-1 | CO初始浓度/mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
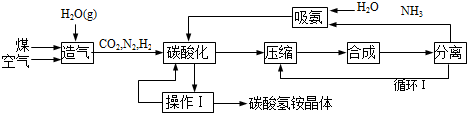

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖水 | B. | 石灰乳 | C. | 氢氧化铁胶体 | D. | 牛奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它不能使酸性高锰酸钾溶液褪色 | B. | 它能发生加成反应和酯化反应 | ||
| C. | 它不能与金属钠反应 | D. | 它不能发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com