
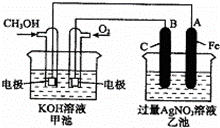
如图是一个化学过程的示意图.已知甲池的总反应式为:
2CH3OH+3O2+4KOH═2K2CO3+6H2O
(1)写出下列电极反应式:通入CH3OH 的电极的电极反应式
是: ,B(石墨)电极的电极反应式为: .
(2)乙池中反应的化学方程式为 .
(3)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上转移电子 mol.
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
(1)甲池能自发的进行氧化还原反应,为原电池,通入甲醇的电极是负极,电极反应式为CH3OH﹣6e﹣+8OH﹣═6H2O+CO32﹣,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣;
乙池为电解池,A是阴极、B是阳极,阳极上氢氧根离子放电、阴极上银离子放电;
(2)乙池中阳极上氢氧根离子放电、阴极上银离子放电;
(3)根据转移电子相等计算转移电子的物质的量.
解答:
解:(1)甲池能自发的进行氧化还原反应,为原电池,通入甲醇的电极是负极,电极反应式为CH3OH﹣6e﹣+8OH﹣═6H2O+CO32﹣,乙池为电解池,石墨作阳极,阳极上氢氧根离子放电生成氧气,电极反应式为4OH﹣﹣4e﹣=O2↑+2H2O,故答案为:CH3OH﹣6e﹣+8OH﹣═6H2O+CO32﹣;4OH﹣﹣4e﹣=O2↑+2H2O;
(2)乙池中阳极上氢氧根离子放电生成氧气、阴极上银离子放电生成银,所以电池反应式为4AgNO3+2H2O 4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O
4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)铁电极上析出银,电极反应式为Ag++e﹣=Ag,n(Ag)= =0.05mol,根据银和转移电子之间的关系式知,转移电子的物质的量=n(Ag)=0.05mol,串联电路中转移电子相等,所以甲池中理论上转移电子0.05mol,故答案为:0.05.
=0.05mol,根据银和转移电子之间的关系式知,转移电子的物质的量=n(Ag)=0.05mol,串联电路中转移电子相等,所以甲池中理论上转移电子0.05mol,故答案为:0.05.
点评:
本题考查了原电池和电解池原理,正确判断原电池和电解池是解本题关键,再结合各个电极上发生的反应来分析解答,难点是电极反应式的书写,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为 。
(2)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知
NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原
因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
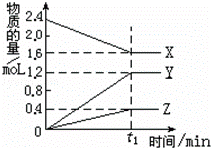
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
(1)①该反应的化学方程式.
②在t1min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为2:3
C.生成3mol Y的同时生成1mol Z
D.生成1mol Z的同时生成2mol X
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,该反应吸收的热量为:;在此t1min时间内,用H2表示反应的平均速率v(H2)=.
②两位同学讨论放热反应和吸热反应.甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应.你认为他们说法正确的是同学.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组混合物中,都能用分液漏斗的是( )
|
| A. | 乙酸乙酯和水 酒精和水 苯酚和水 |
|
| B. | 溴乙烷和水 溴苯和水 硝基苯和水 |
|
| C. | 甘油和水 己烷和水 甲酸和水 |
|
| D. | 苯和甲苯 乙醛和水 乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硝化反应说法正确的是( )
|
| A. | 硝化反应属于取代反应 |
|
| B. | 硝化反应中混合酸的配制是先加浓硫酸再加浓硝酸 |
|
| C. | 甲苯硝化反应的产物只有一种 |
|
| D. | 硝基苯的密度小于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是()
A. 25℃时,pH=13的氨水中含有OH﹣的数目为0.1NA
B. 标准状况下,2.24 LNO2 与水反应生成NO3﹣的数目为0.1NA
C. 1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D. 4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3.已知如表数据,下列叙述正确的是()
物质(25℃) Cu(OH)2 Fe(OH)2 Fe(OH)3
Ksp 2.2×10﹣20 8.0×10﹣16 4.0×10﹣38
完全沉淀时的pH ≥6.4 ≥9.6 ≥3~4
A. 混合溶液中:c(SO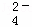 ):=5:4
):=5:4
B. 若向混合溶液中加入铁粉,不可能观察到红色固体析出
C. 若向混合溶液中加入足量氯水,调节pH到3﹣4后过滤,得到纯净的CuSO4溶液
D. 若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分子式为C12H12的物质A的结构简式为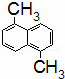 ,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有()
,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有()
A. 9种 B. 10种 C. 11种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)0.7 mol H2O的质量为________,其中含有________个水分子,氢原子的物质的量为________。
(2)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是________,在相同温度和相同压强条件下,体积最大的是________。
(3)2 mol的CO2与3 mol的SO3的分子数比是______;原子数比是________。
(4)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com